长江三角洲区域医疗器械注册人制度试点工作实施方案(试行)(沪药监械管〔2019〕112号)
为深入贯彻落实中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),按照国家药品监督管理局《关于扩大医疗器械
来源:医疗器械注册代办 发布日期:2016-03-04 阅读量:次
附件:肌酸激酶测定试剂(盒)注册技术审查指导原则(2016年修订版)(2016年第28号).doc
本指导原则旨在指导注册申请人对肌酸激酶测定试剂(盒)注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是对肌酸激酶测定试剂(盒)的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
肌酸激酶测定试剂(盒)用于体外定量测定人血清或血浆中肌酸激酶的活性。
从方法学考虑,本指导原则主要指采用分光光度法原理,利用全自动、半自动生化分析仪或分光光度计,在医学实验室进行肌酸激酶定量检验所使用的临床化学体外诊断试剂。本文不适用于干式肌酸激酶测定试剂。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号),肌酸激酶测定试剂盒管理类别为Ⅱ类,分类代码为6840。
(一)综述资料
综述资料主要包括产品预期用途、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《体外诊断试剂注册管理办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求,下面着重介绍与肌酸激酶测定试剂(盒)预期用途有关的临床背景情况。
肌酸激酶(Creatine Kinase,CK)主要存在于骨骼肌和心肌,在脑组织中也存在。急性心肌梗死后的2h—4h,CK活性开始增高,可高达正常上限的10—20倍。但CK对心肌梗死诊断的特异性不高。各种类型的进行性肌萎缩时,血清CK活性增高。神经因素引起的肌萎缩如脊髓灰白质炎时,CK活性正常。皮肌炎时CK活性可轻度或中度增高。病毒性心肌炎时,CK活性也明显升高,对诊断及判断预后有参考价值。
CK增高还见于脑血管意外、脑膜炎、甲状腺功能低下患者。一些非疾病因素如剧烈运动、各种插管及手术、肌内注射冬眠灵和抗生素也可能引起CK活性增高。
注:若注册申报产品声称临床意义超出此内容范围,应提供相关文献或临床研究依据。
(二)主要原材料研究资料(如需提供)
主要原材料的选择、制备、质量标准及实验验证研究资料;质控品、校准品的原料选择、制备、定值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。
(三)主要生产工艺及反应体系的研究资料(如需提供)
1.主要生产工艺介绍,可以图表方式表示;
2.反应原理介绍;
3.确定反应所需物质用量(校准品、样本等)的研究资料
4.确定反应最适条件研究;
5.其他:如基质效应等。
(四)分析性能评估资料
企业应提交在产品研制阶段对试剂盒进行的所有性能验证的研究资料,包括具体研究方法、试验数据、统计方法等详细资料。申请人应按以下要求提供体外诊断试剂性能评估资料:
1.申请人名称;
2.性能评估方法、要求;
3.性能评估所使用试剂(包括校准品、质控品)的名称、批号、有效期;
4.应提供使用的仪器型号、序列号(SN);
5.性能评估的时间、地点、检验人员;
6.性能评估的具体数据及分析判定;
7.性能评估审批人签字、审批时间。
对于本试剂盒,建议着重对以下分析性能进行研究:
1.准确度
对测量准确度的评价依次包括:与国家标准品(和/或国际标准品)的偏差分析、方法学比对等方法,企业可根据实际情况选择合理方法进行研究。
(1)与国家(国际)标准品的比对研究
该研究项目已有相应国家(国际)标准品,优先使用国家(国际)标准品进行验证,重点观察对相应标准品检测结果的偏差情况。
(2)方法学比对
在国家(国际)标准品无法获得的前提下,可采用普遍认为质量较好的已上市同类试剂作为参比方法,与拟申报试剂同时检测一批临床样品,从测定结果间的差异了解拟申报试剂与参比方法间的偏倚。如偏倚很小或在允许的误差范围内,说明两检测系统对病人标本测定结果基本相符,对同一份临床样本的医学解释,拟申报试剂与参比方法相比不会产生差异结果。
在实施方法学比对前,应分别对拟申报试剂和参比试剂进行初步评估,只有在确认两者都分别符合各自相关的质量标准后方可进行比对试验。方法学比对时应注意质量控制、样本类型、浓度分布范围并对结果进行合理的统计学分析。
2.空白吸光度
用生理盐水测试试剂(盒),在37℃、340nm 波长、1cm光径条件下,记录测试启动时的吸光度(A1)和约5 分钟(t)后的吸光度(A2),A2测试结果即为试剂空白吸光度测定值。
3.试剂空白吸光度变化率
记录测试启动时的吸光度(A1)和n分钟(T)后的吸光度(A2),计算出吸光度变化值(),即为试剂空白吸光度变化率(DA/min),应不大于0.002。
4.批内重复性
测量精密度的评估应包括两个浓度水平的样本进行,建议浓度为(35±10)U/L和(200±20)U/L两个浓度都应在试剂盒的测量范围内,重复性测试通常选用一个浓度在正常参考值范围内,一个为医学决定水平值附近,另一个异常高值样本。
5.线性范围
建立试剂线性范围所用的样本基质应尽可能与临床实际检测的样本相似,理想的样本为分析物浓度达到预期测定上限的混合人血清,制备低浓度样本时应充分考虑稀释对样本基质的影响。建立线性范围时,需在预期测定范围内选择7—11个浓度水平。例如,将预期测定范围加宽至130%,在此范围内选择更多的浓度水平,然后依据实验结果逐渐减少数据点(最终不得少于7个水平)直至表现出线性关系,可发现最宽的线性范围。验证线性范围时可选择5—7个浓度水平。
6.分析灵敏度
用已知活性的样品测试试剂(盒),记录试剂(盒)在37℃、340nm波长、1cm光径条件下的吸光度变化率。按照生产企业规定的分析灵敏度计算公式计算分析灵敏度。
7.批间差
用(200±20) U/L的血清样品或质控样品分别测试3个不同批号的试剂(盒),每个批号测试3次,分别计算每批3次测定的均值,计算相对极差。
8.干扰试验
对样本中常见的干扰物质进行检测,如胆红素、血红蛋白、甘油三酯等。方法为对模拟添加样本分别进行验证,样本量选择应体现一定的统计学意义,说明样本的制备方法及干扰实验的评价标准,确定可接受的干扰物质极限浓度。
9.校准品溯源及质控品赋值(如适用)
应参照GB/T 21415—2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,提供企业(工作)校准品及试剂盒配套校准品定值及不确定度计算记录,提供质控品赋值及其靶值范围确定的记录。
10.其他需注意问题
对于适用多个机型的产品,应提供产品说明书【适用仪器】项中所列的所有型号仪器的性能评估资料。
如有多个包装规格,需要对不同包装规格之间的差异进行分析或验证,如不同包装规格产品间存在性能差异,需要提交采用每个包装规格产品的分析性能评估。如不同包装规格之间不存在性能差异,需要提交包装规格之间不存在性能差异的详细说明,具体说明不同包装规格之间的差别及可能产生的影响。
试剂盒的样本类型如包括血清和血浆样本,则应对二者进行相关性研究以确认二者检测结果是否完全一致或存在某种相关性(如系数关系)。对于血浆样本,企业应对不同的抗凝剂进行研究以确认最适的抗凝条件以及是否会干扰检测结果。
(五)参考区间确定资料
应提交建立参考区间所采用样本来源及详细的试验资料。应明确参考人群的筛选标准,研究各组(如性别、年龄等)例数不应低于120例*。
若引用针对中国人群参考值范围研究的相关文献,应明确说明出处,并进行验证。参考值研究结果应在说明书【参考区间】项中进行相应说明。
(六)稳定性研究资料
稳定性研究主要包括效期稳定性、高温加速破坏稳定性、运输稳定性、机载稳定性及开瓶(复溶)稳定性等,企业可根据实际需要选择合理的稳定性研究方案。稳定性研究资料应包括研究方法的确定依据、具体方法及过程。对于实时稳定性研究,应提供至少3批样品在实际储存条件下保存至成品有效期后的研究资料。
应对样本在不同储存条件下的稳定性期限进行研究,并在说明书中样本要求处明示。(注:若有相关文献中已明确说明,亦可作为依据。)
(七)临床评价资料
试剂(盒)按照《关于发布体外诊断试剂临床试验技术指导原则的通告》(国家食品药品监督管理总局通告2014年第16号)执行。
1.研究方法
选择境内已批准上市的性能不低于拟申报产品的同类产品作为参比试剂,采用拟申报产品(以下称考核试剂)与之进行对比试验研究,证明本品与已上市产品等效。
2.临床研究单位的选择
应选择至少两家获得国家食品药品监督管理总局资质认可的医疗机构,临床研究单位实验操作人员应有足够的时间熟悉检测系统的各环节(试剂、质控及操作程序等),熟悉评价方案。在整个实验中,考核试剂和参比试剂都应处于有效的质量控制下,最大限度保证试验数据的准确性及可重复性。
3.伦理要求
临床试验必须符合赫尔辛基宣言的伦理学准则,必须获得临床试验机构伦理委员会的同意,如该临床试验对受试者几乎没有风险,可经伦理委员会审查和批准后免于受试者的知情同意。
4.临床试验方案
临床试验实施前,研究人员应从流行病学、统计学、临床医学、检验医学等多方面考虑,设计科学合理的临床研究方案。各临床研究机构的方案设置应保持一致,且保证在整个临床试验过程中遵循预定的方案实施,不可随意改动。整个试验过程应在临床研究机构的实验室内并由本实验室的技术人员操作完成,申报单位的技术人员除进行必要的技术指导外,不得随意干涉实验进程,尤其是数据收集过程。
试验方案中应确定严格的病例纳入/排除标准,任何已经入选的病例再被排除出临床研究都应记录在案并明确说明原因。在试验操作过程中和判定试验结果时应采用盲法以保证试验结果的客观性。各研究单位选用的参比试剂及所用机型应保持一致,以便进行合理的统计学分析。另外,考核试剂的样本类型应与产品说明书一致,且不应超越参比试剂对样本类型的检测要求,如果选择了参比试剂适用样本类型以外的样本,则应采用临床金标准对额外的样本类型进行验证。
5.研究对象选择
临床试验应选择具有特定症状/体征人群作为研究对象。企业在建立病例纳入标准时,应考虑到不同人群的差异,尽量覆盖各类适用人群。在进行结果统计分析时,建议对各类人群分别进行数据统计分析。
研究总体样本数不少于200例,应充分考虑对病理值样本的验证,异常值样本数建议不少于80例。样本中待测物浓度应覆盖考核试剂线性范围,且尽可能均匀分布。
血清/血浆应明确抗凝剂的要求、存贮条件、可否冻融等要求及避免使用的样本。实验中,尽可能使用新鲜样本,避免贮存。如无法避免使用贮存样品时,注明贮存条件及时间,在数据分析时应考虑其影响。
如果声称同时适用于血清/血浆/全血样本,那么血清(或血浆或全血)的试验例数参照上述要求,并应同时验证其中至少100例受试者的自身血清、血浆和/或全血样本测试结果间的一致性(采用考核试剂评价),其中不同浓度样本分布情况与总例数中分布情况应一致。
如产品发生涉及检测条件优化、增加与原样本类型具有可比性的其他样本类型等变更事项,临床样本总数至少为100例,并在至少两家临床试验机构开展临床试验;变更主要原材料的供应商、参考区间的变化及增加临床适应症等变更事项,应根据产品具体变更情况,酌情增加临床试验总样本数。
6.统计学分析
对临床试验结果的统计应选择合适的统计方法,如相关分析、线性回归、绝对偏倚/偏差及相对偏倚/偏差分析等。对于对比实验的等效性研究,最常用是对考核试剂和参比试剂两组检测结果的相关及线性回归分析,应重点观察相关系数(r值)或判定系数(R2)、回归拟合方程(斜率和y轴截距)等指标。结合临床试验数据的正/偏态分布情况,建议统计学负责人选择合理的统计学方法进行分析,统计分析应可以证明两种方法的检测结果无明显统计学差异。在临床研究方案中应明确统计检验假设,即评价考核试剂与参比试剂是否等效的标准。
7.临床试验总结报告撰写
根据《体外诊断试剂临床试验技术指导原则》的要求,临床试验报告应该对试验的整体设计及各个关键点给予清晰、完整的阐述,应该对整个临床试验实施过程、结果分析、结论等进行条理分明的描述,并应包括必要的基础数据和统计分析方法。建议在临床总结报告中对以下内容进行详述。
(1)临床试验总体设计及方案描述
①临床试验的整体管理情况、临床研究单位选择、临床主要研究人员简介等基本情况介绍。
②病例纳入/排除标准、不同人群的预期选择例数及标准。
③样本类型,样本的收集、处理及保存等。
④统计学方法、统计软件、评价统计结果的标准。
(2)具体的临床试验情况
①考核试剂和参比试剂的名称、批号、有效期及所用机型等信息;
②对各研究单位的病例数、人群分布情况进行总合,建议以列表或图示方式给出具体例数及百分比。
③质量控制,试验人员培训、仪器日常维护、仪器校准、质控品运行情况,对检测精密度、质控品回收(或测量值)、抽查结果评估。
④具体试验过程,样本检测、数据收集、样本长期保存等。
(3)统计学分析
①数据预处理、对异常值或离群值的处理、研究过程中是否涉及对方案的修改。
②定量值相关性和一致性分析
用回归分析验证两种试剂结果的相关性,以y=a+bx和R2的形式给出回归分析的拟合方程,其中:y是考核试剂结果,x是参比试剂结果,b是方程斜率,a是y轴截距,R2是判定系数(通常要求R2≥0.95),计算回归系数及截距的95%可信区间(对于理想的可信区间,回归系数应涵盖“1”, 截距应涵盖“0”)。
给出考核试剂与参比试剂之间的差值(绝对偏倚/偏差)及比值(相对偏倚/偏差)散点图,观察并分析各点的偏倚分布情况。分别计算男性、女性医学决定水平处相对偏倚/偏差及95%置信区间。其医学决定水平处允许相对偏倚/偏差限值应不大于10%。
(4)讨论和结论
对总体结果进行总结性描述并简要分析试验结果,对本次临床研究有无特别说明,最后得出临床试验结论。
(八)产品风险分析资料
申请人应考虑产品寿命周期的各个环节,从预期用途、可能的使用错误、与安全性有关的特征、已知及可预见的危害等方面的判定以及对患者风险的估计进行风险分析,应符合YY/T 0316—2008《医疗器械风险管理对医疗器械的应用》的要求。
(九)产品技术要求
产品技术要求应符合《体外诊断试剂注册管理办法》和《关于发布医疗器械产品技术要求编写指导原则的通告》(国家食品药品监督管理总局通告2014年第9号)的相关规定。如已有相应的国家/行业标准发布,则产品技术要求不得低于其相关要求。
下面就产品技术要求中涉及的相关内容进行简要叙述。
1.产品型号/规格及其划分说明
(1)试剂组成及规格
明确试剂的组成及规格。
(2)试剂盒组成成份
明确试剂盒中每个组分的主要组成成分。
2.性能指标:
(1)外观
符合生产企业规定的正常外观要求。
(2)装量
液体试剂的装量应不少于标示值。
(3)试剂空白吸光度
在37℃、340nm波长、1cm光径条件下,试剂空白吸光度应不大于0.50。
(4)试剂空白吸光度变化率
在37℃、340nm波长、1cm光径条件下,用生理盐水作为样品加入试剂测试时,试剂空白吸光度变化率(DA/min)应不大于0.002。
(5)分析灵敏度
分析灵敏度应符合生产企业声称的要求。
(6)线性区间
测试血清样本,试剂线性在[25,1000] U/L(37℃)区间内:
线性相关系数r应≥0.990;
[25,100] U/L 范围内,线性绝对偏差应不大于±10 U/L;[100,1000] U/L 范围内,线性相对偏差应不大于±10%。
(7)重复性
①批内重复性
用血清样品或质控样品重复测试所得结果的重复性(变异系数,CV)应不大于5%。
②批内瓶间差(干粉或冻干试剂适用)
试剂(盒)批内瓶间差变异系数应不大于5%。
(8)批间差
试剂(盒)批间相对极差应不大于10%。
(9)准确度
可选用以下方法之一进行验证:
①相对偏差
相对偏差应不超过±10%;
②比对试验
相关系数r≥0.975,相对偏差应不超过±10%。
(10)稳定性
①效期稳定性:试剂(盒)在规定的贮存条件下保存至有效期末,产品的性能应至少符合线性、准确度和重复性的要求。
②复溶稳定性(干粉或冻干试剂适用):干粉试剂开瓶后(复溶后)在规定的贮存条件下保存至预期时间内,产品的性能应至少符合线性、准确度和重复性。
(11)校准品和质控品(如适用)
①溯源及赋值说明:肌酸激酶已有国家及国际标准物质,若试剂盒配套校准品和质控品,应参照GB/T 21415—2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求溯源至国家或国际标准物质,并提供校准品溯源性说明及质控品赋值说明。
②性能要求:外观、装量、质控品赋值有效性、干粉或冻干品应包含批内瓶间差、复溶稳定性。
3.检验方法
(1)外观
正常视力目测检查,应符合生产企业规定的正常外观要求。
(2)装量
使用通用量具测量,应不少于标示值。
(3)试剂空白吸光度
用指定空白样品测试试剂(盒),在说明书规定的测试条件下,记录反应结束(T)后的吸光度(A),测试结果即为试剂空白吸光度测定值,应不大于0.50。
(4)试剂空白吸光度变化率
在37℃、340nm波长、1cm光径条件下,用生理盐水作为样品加入试剂测试时,试剂空白吸光度变化率(ΔA/min)应不大于0.002。
(5)分析灵敏度
用已知活性的样品测试试剂(盒),记录试剂(盒)在37℃、340nm波长、1cm光径条件下的吸光度变化率。按照生产企业规定的分析灵敏度计算公式计算分析灵敏度。
(6)线性范围
用达到线性范围上限活性的样品和达到线性范围下限活性的样品,混合成至少5个稀释浓度(xi)。分别测试试剂盒,每个稀释浓度测试3次,分别求出测定结果的均值(yi)。以稀释浓度(xi)为自变量,以测定结果均值(yi)为因变量求出线性回归方程。按公式(1)计算线性回归的相关系数(r)。

稀释浓度(xi)代入求出线性回归方程,计算yi的估计值及yi与估计值的相对偏差或绝对偏差。
(7)重复性
①批内重复性
在重复性条件下,分别用试剂(盒)测试(35±10)U/L和(200±20) U/L的血清样品或质控样品,重复测试至少10次(n≥10),分别计算测量值的平均值()和标准差(s)。计算变异系数(CV),应不大于5%。
②批内瓶间差(干粉或冻干试剂适用)
用(200±20)U/L的血清样品或质控样品测试同一批号的10个待检试剂(盒),并计算10个测量值的平均值(1)和标准差(s1)。
用(200±20)U/L的血清样品或质控样品对该批号的1个待检试剂(盒)重复测试10次,计算结果的均值(2)和标准差(s2)。按公式(2)、(3)计算瓶间差的变异系数(CV)。
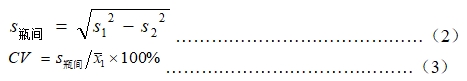
当s1<s2时,令CV=0
每个浓度下试剂(盒)批内瓶间差均应不大于5%。
(8)批间差
用(200±20)U/L的血清样品或质控样品分别测试3个不同批号的试剂(盒),每个批号测试3次,分别计算每批3次测定的均值(i=1,2,3),按公式(4)、(5)计算相对极差(R)。

式中:

(9)准确度
①相对偏差
试剂(盒)测试可用于评价常规方法的有证参考物质(CRM)或其他公认的参考物质3次,测试结果记为(Xi),按公式(6)分别计算相对偏差B,如果3次结果都不超过±10%,即判为合格。如果大于等于2次的结果不符合,即判为不合格。如果有1次结果不符合,则应重新连续测试20次,并分别按照公式(6)计算相对偏差,如果大于等于19次测试的结果都不超过±10%,即判为合格。
B%=(Xi-T)/T×100%………………………………(6)
式中:Xi为测试值;
T为有证参考物质标示值。
②比对试验
用不少于40个在检测浓度范围内不同浓度的临床样品,以生产企业指定的分析系统作为比对方法,每份样品按待测试剂(盒)操作方法及比对方法分别检测。用线性回归方法计算两组结果的相关系数(r)及每个浓度点的相对偏差。相关系数 r≥0.975,[25,100]U/L 范围内,线性绝对偏差应不大于±10 U/L;[100,1000]U/L 范围内,线性相对偏差应不大于±10%。
注:检验时,按以上优先顺序,采用上述方法之一测试试剂(盒)的准确度。
(10)稳定性
①效期稳定性:试剂(盒)在规定的贮存条件下保存至有效期末,产品的性能应至少符合线性、准确度和重复性的要求。
②复溶稳定性(干粉或冻干试剂适用):干粉试剂开瓶后(复溶后)在规定的贮存条件下保存至预期时间内,产品的性能应至少符合线性、准确度和重复性。
(11)校准品和质控品(如适用)
①溯源及赋值说明:肌酸激酶已有国家及国际标准物质,若试剂盒配套校准品和质控品,应参照GB/T 21415—2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求溯源至国家或国际标准物质,并提供校准品溯源性说明及质控品赋值说明。
②性能要求:外观、装量、质控品赋值有效性、干粉或冻干品应包含批内瓶间差、复溶稳定性。
(十)产品注册检验报告
根据《体外诊断试剂注册管理办法》要求,首次申请注册的第二类产品应该在具有相应医疗器械检验资质和承检范围的医疗器械检测机构进行样品的注册检测。对于已经有国家标准品的检测项目,在注册检测时应采用相应的国家标准品进行。注册申报资料中应包括相应的注册检验报告和产品技术要求预评价意见。
(十一)产品说明书
说明书承载了产品预期用途、检验方法、检验结果的解释以及注意事项等重要信息,是指导实验室工作人员正确操作、临床医生针对检验结果给出合理医学解释的重要依据。因此,产品说明书是体外诊断试剂注册申报最重要的文件之一。产品说明书的格式应符合《关于发布体外诊断试剂说明书编写指导原则的通告》(国家食品药品监督管理总局通告2014年第17号)的要求。结合《体外诊断试剂说明书编写指导原则》的要求,下面对肌酸激酶测定试剂(盒)说明书的重点内容进行详细说明,以指导注册申报人员更合理地完成说明书编制。
产品说明书内容原则上应全部用中文进行表述;如含有国际通用或行业内普遍认可的英文缩写,可用括号在中文后标明;对于确实无适当中文表述的词语,可使用相应英文或其缩写。
1.【产品名称】
(1)通用名称:试剂(盒)名称由三部分组成:被测物名称、用途、方法或原理。例如:肌酸激酶测定试剂盒(磷酸肌酸底物法)。名称不能出现样本类型及定量等内容。
(2)英文名称(如有)应当正确、完整、直译,不宜只写缩写。
2.【包装规格】
(1)应与产品技术要求中所列的包装规格一致。
(2)注明装量或可测试的样本数,如××测试/盒、××mL。
3.【预期用途】应包括以下几部分内容:
(1)说明试剂盒用于体外定量测定人血清和/或血浆中肌酸激酶的活性。
(2)与预期用途相关的临床适应症背景情况,如临床适应症的发生率、易感人群等,相关的临床或实验室诊断方法等。
4.【检验原理】
应描述参与反应的底物、酶、产物及反应条件,可用反应式表达。以磷酸肌酸底物法为例,磷酸肌酸在CK的催化下转变成肌酸,同时ADP磷酸化成ATP,然后通过(己糖激酶/葡萄糖-6-磷酸脱氢酶)偶联反应,最终使NADP转变成NADPH,可在特定波长(如:340nm)进行测定。
5.【主要组成成分】
(1)说明试剂盒包含组分的名称、数量、比例或浓度等信息,如果对于正确的操作很重要,应提供其生物学来源、活性及其他特性;明确说明不同批号试剂盒中各组分是否可以互换。
(2)试剂盒内如包含校准品和/或质控品,应说明其主要组成成分及其生物学来源,校准品应注明其定值及溯源性,溯源性至少应写明溯源到的最高级别,包括:标准物质的发布单位及编号,质控品应有合适的靶值范围。
6.【储存条件及有效期】
(1)对试剂盒的效期稳定性、复溶稳定性、开瓶稳定性等信息作详细介绍。包括环境温湿度、避光条件等。
(2)不同组分保存条件及有效期不同时,应分别说明,产品总有效期以其中效期最短的为准。
注:保存条件不应有模糊表述,如“室温”,应明确贮存温度,如2℃—8℃,有效期12个月。稳定期限应以月或日或小时为单位。
7.【适用仪器】
(1)说明可适用的仪器,并提供与仪器有关的必要信息以便用户能够作出最好的选择。
(2)应写明具体适用仪器的型号,不能泛指某一系列仪器。
8.【样本要求】
重点明确以下内容:
(1)样本采集前对患者的要求:如采集时间、采集顺序等,是否受临床症状、用药情况等因素的影响。
(2)样本采集:说明采集方法及样本类型,如有血浆样本,应注明对抗凝剂的要求。
中度及重度溶血时,因红细胞释放出AK、ATP及G6PD,可能影响延滞时间并产生副反应,应说明是否应避免使用此类样本。
(3)样本处理及保存:样本处理方法、保存条件及期限、运输条件等。冷藏/冷冻样本检测前是否须恢复室温,冻融次数。对储存样本的添加剂要求等。
肌酸激酶活性不稳定,血清保存期间易丧失活性,应说明标本采集后的样本处理及保存要求。
(4)因血清中含有肌酸激酶抑制剂,使用水基质进行稀释可能会产生稀释偏差。所以当测定值超出线性上限时,应说明使用厂家提供的专用稀释液或明确稀释方法,并给出稀释最大倍数说明。
9.【检验方法】详细说明试验操作的各个步骤,包括:
(1)试验具体操作步骤。
(2)试剂配制方法、注意事项。
(3)试验条件:温度、时间、仪器波长等以及试验过程中的注意事项。
(4)校准:校准品的使用方法、注意事项、校准曲线的绘制。应注明推荐的仪器校准周期。
(5)质量控制:质控品的使用方法、对质控结果的必要解释以及推荐的质控周期等,如质控不合格应提供相关的解决方案。
10.【参考区间】
(1)应注明常用样本类型的正常参考区间,如健康成年男性:38U/L—174U/L,健康成年女性:26U/L—140U/L;并简要说明参考区间确定的方法。
(2)简单介绍设定该参考区间所选健康人群的区域特征,建议注明以下字样“由于地理、人种、性别及年龄等差异,建议各实验室建立自己的参考区间”。
11.【检验结果的解释】
说明可能对试验结果产生影响的因素;说明在何种情况下需要进行确认试验。
12.【检验方法的局限性】
(1)说明检测结果仅供临床参考,不能单独作为确诊或排除病例的依据。
(2)说明该检验方法由于哪些原因会使测量结果产生偏离,或测量结果还不能完全满足临床需要。如:干扰(胆红素、血红蛋白、甘油三酯等)等。
13.【产品性能指标】
产品性能指标应符合产品技术要求。说明该产品主要性能指标,应至少包括:外观、装量、试剂空白吸光度、试剂空白吸光度变化率、分析灵敏度、线性范围、重复性、批间差、准确度等。
14.【注意事项】应至少包括以下内容:
(1)本试剂盒的检测结果仅供临床参考,对患者的临床诊治应结合其症状/体征、病史、其他实验室检查及治疗反应等情况综合考虑。
(2)使用不同生产商的试剂对同一份样本进行检测可能会存在差异。
(3)对所有样本和反应废弃物都应视为传染源对待,提示操作者采取必要的防护措施。
15.【标识的解释】
如有图形或符号,请解释其代表的意义。
16.【参考文献】
注明引用参考文献,其书写应清楚、易查询且格式规范统一。
17.【基本信息】
(1)注册人与生产企业为同一企业的,按以下格式标注基本信息:
注册人/生产企业名称
住所
联系方式
售后服务单位名称
联系方式
生产地址
生产许可证编号
(2)委托生产的按照以下格式标注基本信息:
注册人/生产企业名称
住所
联系方式
售后服务单位名称
联系方式
受托企业的名称
住所
生产地址
生产许可证编号
18.【医疗器械注册证编号/产品技术要求编号】
注明该产品的注册证书编号/产品技术要求编号。
19.【说明书核准日期及修改日期】
注明该产品说明书的核准日期。如曾进行过说明书的变更申请,还应该同时注明说明书的修改日期。
(一)技术要求中性能指标的设定及检验方法是否符合相关行业标准的要求;技术要求的格式是否符合《医疗器械产品技术要求编写指导原则》的相关规定;
(二)产品说明书的编写内容及格式是否符合《体外诊断试剂说明书编写指导原则》的要求,相关内容是否符合《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)中对说明书的要求。
(三)分析性能评估指标及结果是否满足产品技术要求的规定;是否满足本指导原则中各指标验证的要求。
(四)参考区间确定使用的方法是否合理,数据统计是否符合统计学的相关要求,结论是否和说明书声称一致。
(五)试剂盒的稳定性研究方法是否合理,稳定性结论是否和说明书声称一致。
(六)临床试验采用的样本类型及病例是否满足试剂盒声称的预期用途,样本量及临床研究单位的选择、对比试剂的选择、统计方法及研究结果、临床方案及报告撰写的格式等是否符合《体外诊断试剂临床试验技术指导原则》对相关内容的规定。
(七)产品风险分析资料的撰写是否符合YY/T 0316—2008《医疗器械风险管理对医疗器械的应用》的要求。
(一)准确度(accuracy):一个测量值与可接受的参考值间的一致程度。
(二)线性(linearity):在给定测量范围内,给出的测量结果与样品中实际存在的被测量物的值成比例的能力。线性是描述一个测量系统的测量示值或测量结果相关于样本的赋值符合直线的属性。
(一)《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)
(二)《关于发布体外诊断试剂临床试验技术指导原则的通告》(国家食品药品监督管理总局通告2014年第16号)
(三)《关于发布体外诊断试剂说明书编写指导原则的通告》(国家食品药品监督管理总局通告2014年第17号)
(四)《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)
(五)全国临床检验操作规程(第3版)(原中华人民共和国卫生部医政司)
(六)How to Define and Determine Reference Intervals in the ClinicalLaboratory; Approved Guideline—Second Edition, C28-A2 Vol. 20 No. 13
2014年新的《体外诊断试剂注册管理办法》、《体外诊断试剂临床试验技术指导原则》、《体外诊断试剂说明书编写指导原则》均已发布并代替2007版法规,修订本指导原则旨在适应新的法规要求并指导和规范肌酸激酶测定试剂(盒)产品的技术审评工作,帮助审查人员理解和掌握该类产品原理、组成、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价。同时也可指导注册申请人的产品注册申报。
由于肌酸激酶测定试剂(盒)产品仍在不断发展,审查人员仍需从风险分析的角度认真确认申报产品的预期用途与风险管理是否相当;由于我国医疗器械法规框架仍在构建中,审查人员仍需密切关注相关法规、标准及最新进展,关注审评产品实际组成、原理、预期用途等方面的个性特征,以保证产品审评符合现行法规安全、有效的要求。
(一)《医疗器械监督管理条例》(中华人民共和国国务院令第650号)
(二)《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)
(三)《关于发布体外诊断试剂临床试验技术指导原则的通告》(国家食品药品监督管理总局通告2014年第16号)
(四)《关于发布体外诊断试剂说明书编写指导原则的通告》(国家食品药品监督管理总局通告2014年第17号)
(五)GB/T 26124—2011《临床化学体外诊断试剂(盒)》
(六)YY/T 1243—2014《肌酸激酶测定试剂(盒)》
(七)国家食品药品监督管理部门发布的其他规范性文件
(一)产品说明书根据《体外诊断试剂说明书编写指导原则》做了适当的调整,补充了【标识的解释】和【基本信息】等内容。
(二)将产品标准要求修订为产品技术要求。
(三)产品的具体性能指标主要参考了YY/T 1243—2014《肌酸激酶测定试剂(盒)》行业标准。
(四)临床试验资料要求根据《体外诊断试剂临床试验技术指导原则》做了部分调整,主要有:
1.临床研究单位的选择由原来省级以上变更为获得国家食品药品监督管理总局资质认可的医疗机构;
2.补充了临床伦理的要求,强调了需经伦理委员会审查和批准后免于受试者的知情同意的要求;
3.如该产品适用于血清/血浆/全血样本,那么血清(或血浆或全血)应同时验证的例数由原来的50调整为100;
4.补充了涉及到临床的产品变更的样本例数要求。
(五)根据新的《体外诊断试剂注册管理办法》增加了对风险分析研究资料的要求。
本指导原则的编写成员由北京市医疗器械注册技术审评人员、行政审批人员、临床专家共同组成。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

为深入贯彻落实中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),按照国家药品监督管理局《关于扩大医疗器械

为规范医疗器械注册人跨区域委托生产的监督管理,推进长江三角洲区域医疗器械跨区域监管,根据《中共中央办公厅国务院办公厅关于深化审评审批制度改革鼓励药品医疗器械创新的意见》《

附件:血液透析用水处理设备注册审查指导原则(2024年修订版)(2024年第19号).doc血液透析用水处理设备注册审查指导原则(2024年修订版)本指导原则旨在指导注册申请人对血液透析用水处理设备注册申报资料的准备及撰写,同时也为技术审评部门提供参考。本指导原则是对血液透析用水处理设备的一般要求,注册申请人依据产品的具体特性确定其中内容是否适用。若不适用,要具体阐述理由及相应的科学依据,并依据产

附件:医疗器械监督管理条例(2025年修订版).doc医疗器械监督管理条例(2000年1月4日中华人民共和国国务院令第276号公布 2014年2月12日国务院第

国家药监局器审中心关于发布影像型超声诊断设备(第三类)注册审查指导原则(2023年修订版)的通告(2024年第29号)发布时间:2024-10-14为进一步规范

为深化医疗器械审评审批制度改革,加强医疗器械临床试验管理,根据《医疗器械监督管理条例》(国务院令第739号)及《医疗器械注册与备案管理办法》(市场监管总局令第47号)、《

附件:医用雾化器注册审查指导原则(2024修订版)(2024年第19号).doc 医用雾化器注册审查指导原则(2024年修订版) 本指导原则旨在指导注册申请人提交医用雾化器的注册申报资料,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对医用雾化器的一般性要求,注册申请人应根据申报产品的特性提交注册申报资料,判断指导原则中的具体内容是否适用,不适用内容应阐述理

附件:大便隐血(FOB)检测试剂盒(胶体金免疫层析法)注册审查指导原则(2024年修订版)(2024年第21号).doc大便隐血(FOB)检测试剂盒(胶体金免疫层析法)注册审查指导原则(2024年修订版)本指导原则旨在指导注册申请人对大便隐血(FOB)检测试剂盒(胶体金免疫层析法)注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。本指导原则是对大便隐血(FOB)检测试剂盒(胶

附件:生化分析仪注册审查指导原则(2024年修订版)(2024年第21号).doc 生化分析仪注册审查指导原则(2024年修订版) 本指导原则旨在为注册申请人进行生化分析仪产品的注册申报提供技术指导,同时也为医疗器械监督管理部门对注册申报资料的审评提供技术参考。 本指导原则是对生化分析仪的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理

附件:一次性使用引流管产品注册审查指导原则(2024年修订版)(2024年第21号).doc一次性使用引流管产品注册审查指导原则(2024年修订)本指导原则旨在帮助和指导注册申请人对一次性使用引流管注册申报资料的准备及撰写,同时也为医疗器械技术审评部门对注册申报资料的技术审评提供参考。本指导原则是对一次性使用引流管注册申报资料的一般要求,注册申请人应依据具体产品的特性对注册申报资料的内容进行充分说
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台