【官方解读】国家药监局详细解读2020版《药品注册管理办法》
国家市场监管总局于官网公布《药品注册管理办法》(以下简称“办法”)已于2020年7月1日起正式施行。国家药监局从《办法》修订的背景、思路、引入了哪些新理念和制度、有哪些鼓
来源:医疗器械注册代办 发布日期:2025-07-31 阅读量:次
2025年7月30日,国家药品监督管理局同步发布《应用纳米材料的医疗器械产品分类界定指导原则》和《康复类数字疗法软件产品分类界定指导原则》,首次为两大前沿技术领域建立科学监管框架。新规废止了实施近二十年的"纳米材料器械一律按Ⅲ类管理"旧规,同时为康复数字疗法明确"软件驱动医疗干预"的核心标准,标志着中国医疗器械监管进入精准化时代。
新规彻底改变2006年"纳米生物材料统一按Ⅲ类管理"的刚性模式,建立风险分级新体系:
(1)监管范围精准锁定:仅当纳米材料直接或间接接触人体时纳入监管(如人工关节涂层),排除转运车轮胎等非接触产品
(2)双维度判定逻辑:接触部位决定管理类别,产品功能决定管理属性
| 接触部位 | 管理类别 | 代表产品 |
|---|---|---|
| 体表完好皮肤 | II类 | 纳米远红外热敷贴 |
| 创面/体内组织 | III类 | 纳米骨填充材料 |
(1)抗菌功能为主的产品(如纳米银凝胶)退出医疗器械范畴
(2)抗菌为辅的产品(如纳米银导尿管)升级为III类管理
全球数据机构GlobalData显示,这直接影响62%已上市含纳米银医疗器械的注册资质。
康复类数字疗法首次获得官方定义,必须同时满足三大核心条件:
1.软件程序驱动干预:需主动生成康复方案(如卒中患者运动训练软件)
2.循证医学支撑:基于临床指南或专家共识开发
3.明确医疗用途:标注适应证、禁忌证等临床信息
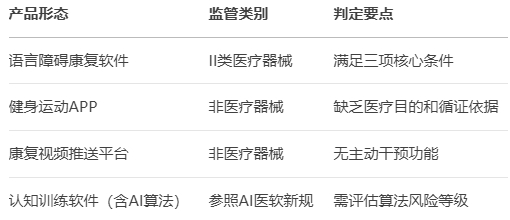
2024年国内23个获批数字疗法产品中,7个因AI算法增加额外审查,平均审批周期延长至14.2个月(数据来源:国家器审中心)。
政策设置两年缓冲期:
(1)纳米材料器械:2027年8月前未完成类别变更的将禁止销售
(2)数字疗法产品:现有II类证需补充循证医学证据
某头部敷料企业透露,纳米银伤口贴重新分类将增加300万元检测成本。而数字疗法企业"睿健时代"表示,新规使其认知康复软件明确归属II类,临床试验方案优化后进度提速40%。
新规推动三大变革:
1.创新资源再分配:纳米研发聚焦体内植入器械,数字疗法企业强化临床验证
2.跨国监管接轨:纳米分类参照欧盟2024年新规,数字疗法采纳ISO国际标准
3.患者安全保障:要求纳米器械上市后监测颗粒释放数据,数字疗法持续验证算法有效性
国家药监局表示,将每两年更新指导原则,保持与技术演进同步。医疗器械行业协会正组织专家编写实操指南,预计2025年10月发布。
> 本文数据来源:国家药监局2025年第27号通告、GlobalData医疗器械数据库、动脉网《2025数字疗法产业报告》

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

国家市场监管总局于官网公布《药品注册管理办法》(以下简称“办法”)已于2020年7月1日起正式施行。国家药监局从《办法》修订的背景、思路、引入了哪些新理念和制度、有哪些鼓

生物材料在疾病治疗和医疗保健中发挥了重要的作用,按材料性质,生物材料可分为惰性材料与可降解性材料两种,目前生物材料的发展呈现出由惰性向可降解性(水解和酶降解)转变的趋
可吸收高分子材料介绍,及其在植入医疗器械中的应用。1、植入产品的定义国家食品药品监督管理局《医疗器械分类规则》(局令第15号)第八条中对“植入器械”的定义为:任何借助

2021年2月5日,湖南省药监局分别与湖南省计量检测研究院、湖南新领航检测技术有限公司、湖南普瑞玛药物研究中心有限公司、深圳华通威国际检验有限公司、南德认证检测(中国)有限公

目前种植义齿已经广泛应用于牙列缺损和牙列缺失的患者,钛及钛合金因其具有良好的生物相容性、力学强度及耐腐蚀性,而成为口腔种植体的首选材料。但随着材料学的发展和处理、

为进一步规范体外诊断试剂的管理,国家药监局器审中心组织制定了《人类SDC2基因甲基化检测试剂临床试验资料技术审评要点》、《异常凝血酶原测定试剂临床试验资料技术审评要点》

国家药监局器审中心关于发布定性检测体外诊断试剂分析性能评估等6项医疗器械产品注册审查指导原则的通告(2022年第36号) 发布时间:2022-09-28 为进一步规范定性检测体外诊断试剂分析

国家药监局关于贯彻实施《化妆品监督管理条例》有关事项的公告(2020年 第144号)发布时间:2020-12-28,2020年6月29日,国务院颁布《化妆品监督管理条例》(以下简称《条例》),自

为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了《关节镜下无源手术器械产品注册审查指导原则》《一次性使用输尿管导引鞘注

为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了《一次性使用高压造影注射器及附件产品注册审查指导原则》《金属接骨板内固
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台