有源医疗器械加速老化试验效期验证及使用期限验证流程
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有
来源:医疗器械注册代办 发布日期:2025-07-31 阅读量:次
在上海崇明区经营医疗器械的叶先生最近体验了一把“零跑腿”办事。他的公司因经营范围调整需要变更许可证,按照以往流程需等待两周的现场核查,如今通过线上提交承诺书,当天就拿到了新证。“以前总要腾出时间配合检查,现在省下的精力能专注业务拓展。”叶先生感慨道。这一变化源于2025年5月上海药监局推出的医疗器械经营“免现场核查”政策,崇明区作为首批试点,正为行业注入新活力。
崇明区市场监管局建立“承诺+审批”双轨机制,对四类情形开放绿色通道:
1.许可延续且一年内通过核查的企业
2.缩减经营场地或范围的企业
3.仅因国家目录调整变更范围的企业
4.已获外省库房核查的跨区经营企业
企业只需在线提交《免现场核查申请表》及合规承诺书,声明经营条件符合《医疗器械经营质量管理规范》。审批人员通过“企业信用大数据平台”调取历史监管记录,信用良好的企业最快当天取证。首批19家试点企业中,85%实现24小时内办结,较传统流程提速5倍以上。
免核查不等于放松监管。崇明区构建三重防护网:
当系统监测到企业两年内存在质量抽检不合格、行政处罚或未履行承诺等八类情形,将自动触发现场核查。某生物科技公司因仓库温控记录异常,在申请延续许可时被系统拦截,经现场整改达标后才获批。
新政直接降低企业合规成本。经营体外诊断试剂的康健医疗算了一笔账:免核查后,每次许可证变更节省约2万元人员误工费和第三方咨询费。公司负责人表示:“省下的费用已投入冷链设备升级,形成良性循环。”
崇明市场监管局定期复核免核查企业:
1.每季度抽查20%企业仓储管理
2.对承诺事项开展“双随机”飞行检查
3.建立失信企业联合惩戒名单
三个月来已对3家未履行承诺企业取消免核查资格,其中1家因隐瞒仓库地址变更被处以暂停经营许可。
医疗器械分销企业成为最大受益群体。崇明国际医疗产业园内,3家供应链企业借助新政快速扩展低温产品代理资质,为岛上医疗机构提供24小时应急配送服务。区内二类器械经营备案量同比增长37%,政策虹吸效应初步显现。
崇明市场监管局透露,下一步将探索免核查政策与长三角监管互认衔接。随着上海“医疗器械经营者主体责任清单”即将出台,以信用为核心的新型监管模式有望在全市复制推广,让更多企业享受“承诺即准营”的改革红利。
| 业务类型 | 适用条件 | 所需材料 |
|---|---|---|
| 许可证延续 | 一年内通过核查且无整改项 | 原核查报告+承诺书 |
| 经营范围变更 | 仅因国家目录调整 | 变更对照表+承诺书 |
| 增设外省库房 | 已获当地监管部门核查 | 外省核查证明+承诺书 |
(数据来源:崇明市场监管局2025年政策白皮书)

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
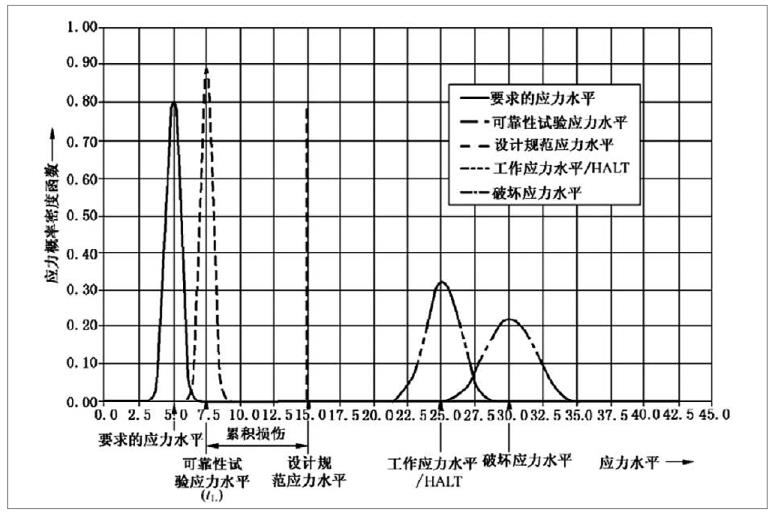
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有

润滑剂类产品在美国根据产品预期用途的不同主要分为人体润滑剂和患者润滑剂:其中,人体润滑剂主要成分为水、丙二醇、羟乙基纤维素、苯甲酸、卡波姆、氢氧化钠等,作用于生殖

中国能排进世界十大医疗器械制造强国吗?暂时还不能,因为排进前十的国家都有许多知名械企和世界级医疗器械巨头;而中国比较出名的可能只有迈瑞了,其他械企仍需努力了。下面

本文介绍了欧盟医疗器械新法规MDR相比于将替代的MDD法规的几点新增要求。建议收藏学习。明年5月份起,Medical Devices Regulation(MDR)(2017/745/ EU)将替代原本的Medical Devices Directive (93

医疗器械注册费是行政性收费,按照注册单元收取,部分省份不收取医疗器械注册费用,绝大部分省份还是收取的。本篇文章统计了截止到2022年1月5日各地医疗器械注册收费标准。

生物材料在疾病治疗和医疗保健中发挥了重要的作用,按材料性质,生物材料可分为惰性材料与可降解性材料两种,目前生物材料的发展呈现出由惰性向可降解性(水解和酶降解)转变的趋

为规范医疗器械(含体外诊断试剂)注册管理,根据国家药监局《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2021年第121号)、《关于公布体外诊断试剂注册申报
可吸收高分子材料介绍,及其在植入医疗器械中的应用。1、植入产品的定义国家食品药品监督管理局《医疗器械分类规则》(局令第15号)第八条中对“植入器械”的定义为:任何借助

一个产品带有CE 标志(标记) 也就意味着其制造商宣告:该产品符合欧洲的健康、安全、与环境保护之相关法律中所规定 的基本要求。因而该产品是对:使用者(译者注:人)、宠物(

2021年2月5日,湖南省药监局分别与湖南省计量检测研究院、湖南新领航检测技术有限公司、湖南普瑞玛药物研究中心有限公司、深圳华通威国际检验有限公司、南德认证检测(中国)有限公
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台