
第三类医疗器械注册变更(许可事项变更)服务
根据《医疗器械监督管理条例》(650号文件)十四条的规定,已拿到第三类医疗器械注册证的产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该...
服务价:¥电议
好评系数:
根据《医疗器械监督管理条例》(650号文件)十四条的规定,已拿到第三类医疗器械注册证的产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该医疗器械安全、有效的,注册人应当向原注册部门申请办理三类医疗器械注册变更手续。
三类医疗器械注册变更(许可事项变更)申报资料
1、申请表。
2、证明性文件:企业营业执照副本复印件和组织机构代码证复印件。
3、注册人关于变更情况的声明。
4、原医疗器械注册证及其附件复印件、历次医疗器械注册变更文件复印件。
5、变更申请项目申报资料要求(根据具体变更情况选择提交以下文件):
(1)产品名称变化的对比表及说明;
(2)产品技术要求变化的对比表及说明;
(3)型号、规格变化的对比表及说明;
(4)结构及组成变化的对比表及说明;
(5)产品适用范围变化的对比表及说明;
(6)注册证中“其他内容”变化的对比表及说明;
(7)其他变化的说明。
6、与产品变化相关的安全风险管理报告。
7、变化部分对产品安全性、有效性影响的资料:分析并说明变化部分对产品安全性、有效性的影响,并提供相关的研究资料。适用范围变化的必须提供临床评价资料。
8、针对产品技术要求变化部分的注册检验报告。
9、符合性声明:
(1)注册人声明本产品符合《医疗器械注册管理办法》和相关法规的要求;声明本产品符合现行国家标准、行业标准,并提供符合标准的清单。
(3)所提交资料真实性的自我保证声明。
官方办理流程

第三类医疗器械注册变更(许可事项变更)服务流程
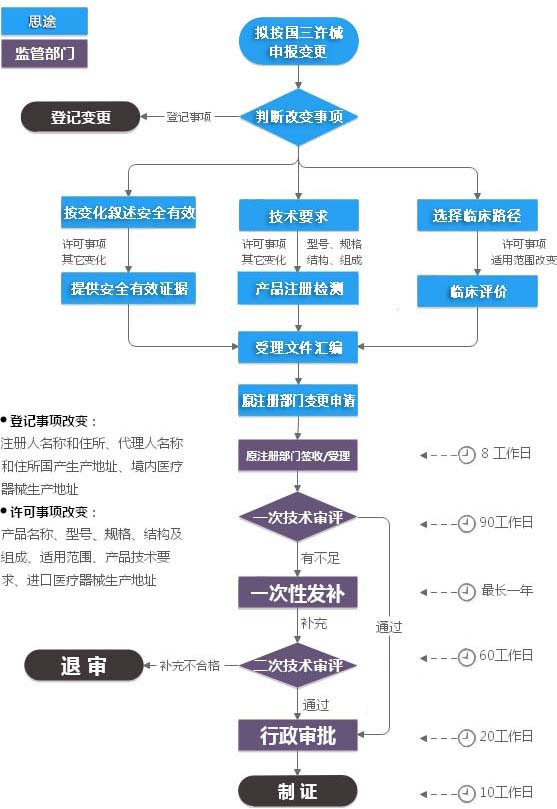
备注
* 产品名称、型号、规格、结构及组成、适用范围、产品技术要求、进口医疗器械生产地址等发生变化的,注册人应当向原注册部门申请许可事项变更。
* 注册人名称和住所、代理人名称和住所发生变化的,注册人应当向原注册部门申请登记事项变更;境内医疗器械生产地址变更的,注册人应当在相应的生产许可变更后办理注册登记事项变更。
第三类医疗器械注册变更(许可事项变更)官方收费标准
| 主管部门 | 管理类别 | 首次注册 | 注册变更 (许可事项变更) | 延续注册 (五年一次) | 临床试验申请费 (高风险医疗器械) | 相关文件 | 实施日期 | ||
|---|---|---|---|---|---|---|---|---|---|
| 国家局 | 境内 | Ⅲ | 15.36 | 5.04 | 4.08 | 4.32 | 局令15年53号 | 2015/5/27 | |
第三类医疗器械注册变更(许可事项变更)服务办理依据
| 文件名称 | 文号 |
|---|---|
| 《医疗器械监督管理条例》 | 650号文件 |
| 《医疗器械注册管理办法》 | 局令4号 |
| 《医疗器械生产监督管理办法》 | 局令7号 |
第三类医疗器械注册变更(许可事项变更)服务周期
立项阶段
预算、合同、考虑期,预计7个工作日。
受理前资料准备
变更资料编制,预计15个工作日。
考虑检测平均消耗6个月,视产品情况有所变化,如无强标更新,则可免除检测。
如需精算请联络思途。(免临床目录产品除外。)
注册变更资料编制可与检测并行。
受理后
CFDA法定消耗预算10个月。(188工日,20工日/月,不计节假。)
发补时限0~6个月,考虑平均时间3个月。视产品首次申报资料情况而定。
预算合计
三类医疗器械注册证许可事项变更(无需检测),周期应至少11~17个月以上。
第三类医疗器械注册变更(许可事项变更)相关服务
| 注册变更资料编写服务 | 注册资料递交(网上和跑腿)服务 |
| 延伸:GMP年度辅导服务 | 延伸:医疗器械临床试验服务 |

立即咨询
 最新文章
最新文章 2026-01-25
2026-01-25 2026-01-24
2026-01-24 2026-01-23
2026-01-23 2026-01-22
2026-01-22 2026-01-21
2026-01-21六年
医疗器械服务经验
-
多一份参考,总有益处
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台
- 在线咨询











 豫公网安备 41010202003160号
豫公网安备 41010202003160号 