
第二类体外诊断试剂注册证(首次注册)服务
依据《体外诊断试剂注册与备案管理办法》第六条规定,申请境内第二类体外诊断试剂产品注册的,由省、自治区、直辖市药监管理部门审查,批准后发给医疗器械注册证。二类ivd产品范围如...
服务价:¥电议
好评系数:
依据《体外诊断试剂注册与备案管理办法》第六条规定,申请境内第二类体外诊断试剂产品注册的,由省、自治区、直辖市药监管理部门审查,批准后发给医疗器械注册证。二类体外诊断试剂ivd产品范围如下:
| 类别 | 产品范围 | 分类注册管理 |
|---|---|---|
| 第Ⅱ类产品 |
1、用于蛋白质检测的试剂; 2、用于糖类检测的试剂; 3、用于激素检测的试剂; 4、用于酶类检测的试剂; 5、用于脂类检测的试剂; 6、用于维生素检测的试剂; 7、用于无机离子检测的试剂; 8、用于药物及药物代谢物检测的试剂; 9、用于自身抗体检测的试剂; 10、用于微生物鉴别或药敏试验的试剂; 11、用于其他生理、生化或免疫功能指标检测的试剂; |
由省、自治区、直辖市药品监督管理部门审查,批准后发给医疗器械注册证书。 |
第二类体外诊断试剂首次注册的申报条件
根据体外诊断试剂注册管理办法的规定,在中国境内销售、使用的第二类体外诊断试剂,必须先通过申请注册。对于境内首次申请注册第二类体外诊断试剂,需要满足下列条件:
1、申请注册的产品已经列入国家药品监督管理总局制定的体外诊断试剂产品分类目录,且管理类别为第二类。如果是新研制尚未列入分类目录的体外诊断试剂,申请人可以直接向国家药品监督管理总局申请第三类体外诊断试剂产品注册,也可以依据分类规则判断产品类别并向国家药品监督管理总局申请类别确认后,再申请产品注册或者办理产品备案。
2、申请人必须是所在申请辖区范围依法进行登记的企业。
3、申请人建立与产品研制、生产有关的质量管理体系,并保持有效运行,而且申请注册时样品不得委托其他企业生产,按照创新医疗器械特别审批程序审批的产品除外。
4、办理体外诊断试剂注册事务的人员应当具有相应的专业知识,熟悉医疗器械注册管理的法律、法规、规章和技术要求。申请人申请注册,应当遵循体外诊断试剂安全有效的各项要求,保证研制过程规范,所有数据真实、完整和可溯源。
5、申请注册的资料应当使用中文,如果是根据外文资料翻译的,应当同时提供原文;如果引用未公开发表的文献资料时,应当提供资料所有者许可使用的证明文件。
6、申请要符合体外诊断试剂注册管理办法的规定,申报材料经技术审评机构技术审评,而且符合安全、有效要求。
二类IVD产品首次注册申报资料要求
1、申请表
申请人应当根据要求填写注册申请表。
2、证明性文件
(1)申请人营业执照副本及生产企业许可证复印件(所申请产品应当在生产企业许可证核定的生产范围之内)。
(2)申请人有关提交资料真实性的声明。
3、综述资料
(1)产品的预期用途:产品的预期用途,与预期用途相关的临床适应症背景情况,如临床适应症的发生率、易感人群等,相关的临床或实验室诊断方法等。
(2)产品描述:包括产品所采用的技术原理,主要原材料的来源及制备方法,主要生产工艺过程,质控品、标准品(校准品)的制备方法及溯源情况。
(3)有关生物安全性方面的说明:由于体外诊断试剂中的主要原材料可能是由各种动物、病原体、人源的组织和体液等生物材料经处理或添加某些物质制备而成,为保证产品在运输、使用过程中对使用者和环境的安全,研究者对上述原材料所采用的灭活等试验方法的说明。
(4)有关产品主要研究结果的总结和评价。
(5)其他:包括同类产品在国内外批准上市的情况。相关产品所采用的技术方法及临床应用情况,申请注册产品与国内外同类产品的异同等。对于新诊断试剂产品,需提供被测物与预期适用的临床适应症之间关系的文献资料。
4、产品说明书
应当符合《医疗器械说明书、标签和包装标识管理规定》的有关要求,并参考有关技术指导原则编写。
说明书中的产品名称可同时包括通用名称、商品名称和英文名称。通用名称应当符合《体外诊断试剂注册与备案管理办法》中有关的命名原则。
5、拟订产品标准及编制说明
拟订产品标准的文本及编制说明应当符合《医疗器械标准管理办法》的相关规定。对于第三类产品,拟订产品标准的内容应当参照《生物制品规程》(2000版)编制。
6、注册检测报告
由国家药品监督管理局认可的检测机构出具的注册检测报告。
7、分析性能评估资料
一般情况下,分析性能评估包括分析灵敏度、分析特异性、检测范围、测定准确性、批内不精密度、批间不精密度等项目。
分析性能评估结果是制定产品标准的重要基础。研发者应当采用多批产品进行上述等项目的性能评估。通过对多批产品性能评估结果进行统计分析制定拟订产品标准,以有效地控制产品生产工艺及产品质量的稳定。
如注册申请中包括不同的包装规格,或该产品适用不同机型,则需要采用每个包装规格产品,或在不同机型上进行上述项目评估的试验资料。
8、参考值(范围)确定资料
应详细说明确定参考值(参考范围)所采用的样本来源,说明参考值(参考范围)确定的方法,并提供参考值(参考范围)确定的详细试验资料。
9、稳定性研究资料
包括至少三批样品在实际储存条件下保存至成品有效期后的稳定性研究资料,必要时应当提供加速破坏性试验资料。
10、临床试验资料
应当参考有关技术指导原则开展临床试验,并提供临床试验资料。
(1)临床试验协议及临床试验方案。
(2)各临床试验机构的临床试验报告、对所有临床试验结果的总结报告。各临床试验机构的试验报告需加盖临床试验主管部门公章。(包含骑缝章)
(3)附件:临床试验的详细资料,包括所有临床试验结果、同时采用的其他试验方法或其他诊断试剂产品的基本信息,如试验方法、诊断试剂产品来源、产品说明书及注册批准情况等。
注:对于校准品、质控品、参比液等不需提供临床试验资料。
11、生产及自检记录
提供连续三批产品生产及自检记录的复印件。
12、包装、标签样稿
应当符合《医疗器械说明书、标签和包装标识管理规定》的要求。
产品外包装上的标签必须包括通用名称、生产企业名称、产品批号、注意事项。可同时标注产品的通用名称、商品名称和英文名。通用名称应当符合《体外诊断试剂注册管理办法》中有关的命名原则。
对于体外诊断试剂产品中的各种组份如校准品、质控品、清洗液等,其包装、标签上必须标注该组份的中文名称和批号。如果同批号产品、不同批号的各种组份不能替换,则既要注明产品批号,也要注明各种组份的批号。
13、质量管理体系考核报告
首次申请第二类产品注册时,应当提供相应的药品监督管理部门出具的质量管理体系考核报告。
注:各省申请资料有所不同,请按企业所在省局公布资料为准。
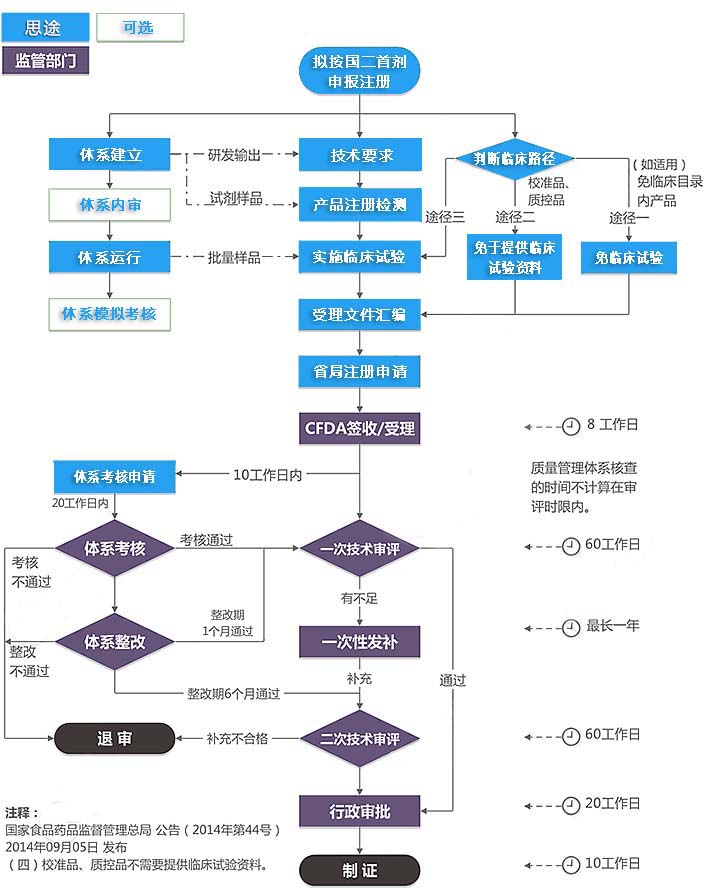
第二类IVD注册证(首次注册)服务流程
第二类IVD注册证(首次注册)收费标准
| 主管部门 | 管理类别 | 首次注册 |
注册变更 (许可事项变更) |
延续注册 (五年一次) |
相关文件 | 实施日期 | ||
|---|---|---|---|---|---|---|---|---|
|
省 局 |
1 | 福建省 | Ⅱ | 5.77 | 2.42 | 2.39 |
闽发改服价函〔2021〕 361号 |
2021/9/1 |
| 2 | 江西省 | Ⅱ | 3.8272 | 1.602 | 1.587 | 赣发改价管〔2023〕670号 | 2023/11/1 | |
| 3 | 上海市 | Ⅱ | 2.3005.5 | 0.9628.5 | 0.9555 | 沪药监公告﹝2024﹞1号 |
2024年4月1日 (截止25年12月31日) |
|
| 4 | 海南省 | Ⅱ | 4.067 | 1.6856 | 1.6709 | 琼发改收费〔2021〕424号 | 2021/6/15 | |
| 5 | 山东省 | Ⅱ | 4.6 | 1.92 | 1.9 | 鲁发改成本[2022]761号 |
2022/9/30 (截止25年10月7日) |
|
| 6 | 安徽省 | Ⅱ | 4.5045 | 1.4651 | 1.0395 | 皖发改价费函〔2024〕440号 |
2023/12/29 (截止26年1月1日) |
|
| 7 | 浙江省 | Ⅱ | 4.6011 | 1.5405 | 1.5288 | 浙药监械[2023]2号 | 2023/8/31 | |
| 8 | 山西省 | Ⅱ | 1.26 | 0.48 | 0.48 | 晋发改收费发〔2023〕361号 | 2023/9/18 | |
| 9 | 云南省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 10 | 河北省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 11 | 江苏省 | Ⅱ |
5.915 小微企业免征 |
2.471 | 2.457 | 苏发改收管发[2019]91号 | 2019/2/13 | |
| 12 | 宁夏 | Ⅱ | 0.75 | 0.325 | 0 | 宁发改价格(调控)函〔2025〕53号 | 2025/2/19 | |
| 13 | 黑龙江 | Ⅱ | 3.312 | 1.403 | 1.38 | 黑发改价格〔2020〕712 号 | 2024/6/10 | |
| 14 | 广东省 | Ⅱ | 5.726 | 2.394 | 2.38 | 粤发改价格函〔2019〕666号 | 2019/2/25 | |
| 15 | 湖南省 | Ⅱ | 5.04 | 2.114 | 2.1 | 湘发改价费规〔2024〕416号 | 2024/6/10 | |
| 16 | 四川省 | Ⅱ | 3.90 | 1.60 | 1.60 | 川发改价格〔2024〕585号 |
2024/12/1 (截止2029年12月1日) |
|
| 17 | 贵州省 | Ⅱ | 2.145 | 0.88 | 0.88 | 黔发改价格〔2024〕787号 | 2024/12/31 | |
| 18 | 广西 | Ⅱ | 2.0187 | 1.264 | 0 | 桂发改价费函〔2024〕1327号 | 2024/6/11 | |
| 19 | 辽宁省 | Ⅱ | 5 | 2.1 | 2.1 | 辽药监告〔2023〕70号 | 2023/7/20 | |
| 20 | 吉林省 | Ⅱ | 0 | 0 | 0 | 吉政发〔2020〕4号 | 2020/2/8 | |
| 21 | 湖北省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 22 | 河南省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 23 | 重庆市 | Ⅱ | 0 | 0 | 0 | 渝府办发〔2019〕56号 | 2019/5/15 | |
| 24 | 甘肃省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 25 | 新疆 | Ⅱ | 0.28 | 0.24 | 0.12 | 新发改收费〔2024〕158 号 | 2024/4/18 | |
| 26 | 内蒙古 | Ⅱ | 0 | 0 | 0 | 内发改费字〔2019〕773号 | 2019/9/17 | |
| 27 | 北京市 | Ⅱ | 0 | 0 | 0 | 京发改[2019]569号 | 2019/4/25 | |
| 28 | 天津市 | Ⅱ | 0 | 0 | 0 | 津党发[2018]39号 | 2019/1/4 | |
| 29 | 陕西省 | Ⅱ | 0 | 0 | 0 | 陕财税[2019]26号 | 2020/1/10 | |
更新时间:2025年5月6日
单位:万元
第二类IVD注册证(首次注册)办理依据
| 文件名称 | 文号 |
|---|---|
| 《医疗器械监督管理条例》 | 650号文件 |
| 《体外诊断试剂注册与备案管理办法》 | 市场监督管理总局令第48号 |
第二类IVD注册证(首次注册)服务周期
立项阶段
预算、合同、考虑期,约2个工作日。
产品检测,平均4个月。(客户自行送检)
受理前资料准备
客户资料对接(视客户情况而定),至少3个工作日。
临床试验不可与检测并行,临床应单独核算时间。至少6个月。
注册资料编制可与检测或临床并行,资料编制约1个月。
受理后
省CFDA法定办结时限3个月。(93个工作日,不计节假)
发补资料准备时限0~2个月视产品首次申报资料情况而定。平均1个月
*体系考核,注册受理后,额外30工作日。需预留1.5个月。
预算合计
无临床试验国内二类IVD首次注册 预算平均5个月
有临床试验国内二类IVD首次注册 预算应考虑10个月。
第二类IVD注册证(首次注册)相关服务
| 注册资料编写服务 | 外聘专家审核注册、临床方案服务 |
| 发补资料整改服务 | 延伸:ivd临床试验服务 |
| 延伸:二类ivd注册延续服务 | 延伸:生产许可代办服务 |

立即咨询
- 上一篇: 第二类医疗器械注册证(首次注册)服务
- 下一篇: 进口第二类医疗器械注册证(首次注册)服务
 最新文章
最新文章 2026-01-25
2026-01-25 2026-01-24
2026-01-24 2026-01-23
2026-01-23 2026-01-22
2026-01-22 2026-01-21
2026-01-21六年
医疗器械服务经验
-
多一份参考,总有益处
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台
- 在线咨询











 豫公网安备 41010202003160号
豫公网安备 41010202003160号 
