
第二类体外诊断试剂IVD注册证变更(许可事项变更)服务
已注册的第二类体外诊断试剂,医疗器械注册证及其附件载明的内容发生变化,注册人应当向原注册部门申请注册变更,并按照相关要求提交申报资料。 注册证及附件载明内容发生以下...
服务价:¥电议
好评系数:
已注册的第二类体外诊断试剂,医疗器械注册证及其附件载明的内容发生变化,注册人应当向原注册部门申请注册变更,并按照相关要求提交申报资料。 注册证及附件载明内容发生以下变化的,申请人应当向原注册部门申请许可事项变更。境内第二类体外诊断试剂注册变更由省、自治区、直辖市食品药品监督管理部门审查。
许可事项变更范畴
1、抗原、抗体等主要材料供应商变更的;
2、检测条件、阳性判断值或者参考区间变更的;
3、注册产品技术要求内容变更;
4、包装规格变更;
5、适用机型变更;
6、产品储存条件或者产品有效期变更的;
7、预期用途表更;
8、产品名称变更;
9、产品说明书变更;
10、可能影响产品安全性、有效性的其他变更。
二类IVD注册证变更(许可事项变更)办理资料
1、《体外诊断试剂注册变更申请表》(许可事项);
2、证明性文件;
3、注册人关于变更情况的声明;
4、原医疗器械注册证及其附件复印件、历次医疗器械注册变更文件复印件;
5、变更申请项目申报技术资料的要求(资料中涉及需要提交产品技术要求、说明书的,另需提交Word文档形式的电子文本);
6、符合性声明;
7、申办人身份证复印件。申办人不是营业执照载明的法定代表人或负责人的,应提交法定代表人或负责人的授权委托书。
第二类IVD注册证变更(许可事项变更)服务流程
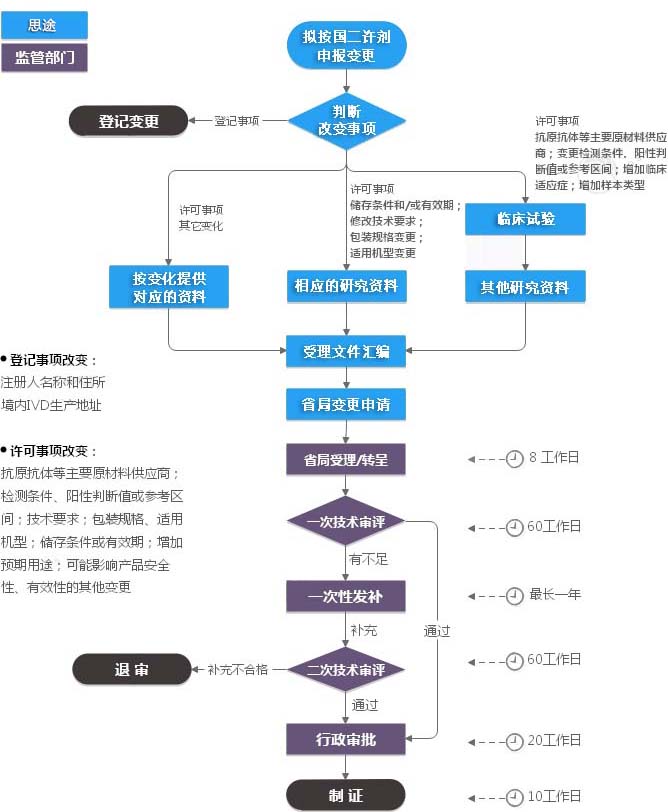
第二类IVD注册证变更(许可事项变更)收费标准
| 主管部门 | 管理类别 | 首次注册 | 注册变更 (许可事项变更) | 延续注册 (五年一次) | 相关文件 | 实施日期 | ||
|---|---|---|---|---|---|---|---|---|
| 省 局 | 1 | 福建省 | Ⅱ | 5.77 | 2.42 | 2.39 | 闽发改服价函〔2021〕 361号 | 2021/9/1 |
| 2 | 江西省 | Ⅱ | 3.8272 | 1.602 | 1.587 | 赣发改价管〔2023〕670号 | 2023/11/1 | |
| 3 | 上海市 | Ⅱ | 2.3005.5 | 0.9628.5 | 0.9555 | 沪药监公告﹝2024﹞1号 | 2024年4月1日 (截止25年12月31日) | |
| 4 | 海南省 | Ⅱ | 4.067 | 1.6856 | 1.6709 | 琼发改收费〔2021〕424号 | 2021/6/15 | |
| 5 | 山东省 | Ⅱ | 4.6 | 1.92 | 1.9 | 鲁发改成本[2022]761号 | 2022/9/30 (截止25年10月7日) | |
| 6 | 安徽省 | Ⅱ | 4.5045 | 1.4651 | 1.0395 | 皖发改价费函〔2024〕440号 | 2023/12/29 (截止26年1月1日) | |
| 7 | 浙江省 | Ⅱ | 4.6011 | 1.5405 | 1.5288 | 浙药监械[2023]2号 | 2023/8/31 | |
| 8 | 山西省 | Ⅱ | 1.26 | 0.48 | 0.48 | 晋发改收费发〔2023〕361号 | 2023/9/18 | |
| 9 | 云南省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 10 | 河北省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 11 | 江苏省 | Ⅱ | 5.915 小微企业免征 | 2.471 | 2.457 | 苏发改收管发[2019]91号 | 2019/2/13 | |
| 12 | 宁夏 | Ⅱ | 0.75 | 0.325 | 0 | 宁发改价格(调控)函〔2025〕53号 | 2025/2/19 | |
| 13 | 黑龙江 | Ⅱ | 3.312 | 1.403 | 1.38 | 黑发改价格〔2020〕712 号 | 2024/6/10 | |
| 14 | 广东省 | Ⅱ | 5.726 | 2.394 | 2.38 | 粤发改价格函〔2019〕666号 | 2019/2/25 | |
| 15 | 湖南省 | Ⅱ | 5.04 | 2.114 | 2.1 | 湘发改价费规〔2024〕416号 | 2024/6/10 | |
| 16 | 四川省 | Ⅱ | 3.90 | 1.60 | 1.60 | 川发改价格〔2024〕585号 | 2024/12/1 (截止2029年12月1日) | |
| 17 | 贵州省 | Ⅱ | 2.145 | 0.88 | 0.88 | 黔发改价格〔2024〕787号 | 2024/12/31 | |
| 18 | 广西 | Ⅱ | 2.0187 | 1.264 | 0 | 桂发改价费函〔2024〕1327号 | 2024/6/11 | |
| 19 | 辽宁省 | Ⅱ | 5 | 2.1 | 2.1 | 辽药监告〔2023〕70号 | 2023/7/20 | |
| 20 | 吉林省 | Ⅱ | 0 | 0 | 0 | 吉政发〔2020〕4号 | 2020/2/8 | |
| 21 | 湖北省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 22 | 河南省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 23 | 重庆市 | Ⅱ | 0 | 0 | 0 | 渝府办发〔2019〕56号 | 2019/5/15 | |
| 24 | 甘肃省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 25 | 新疆 | Ⅱ | 0.28 | 0.24 | 0.12 | 新发改收费〔2024〕158 号 | 2024/4/18 | |
| 26 | 内蒙古 | Ⅱ | 0 | 0 | 0 | 内发改费字〔2019〕773号 | 2019/9/17 | |
| 27 | 北京市 | Ⅱ | 0 | 0 | 0 | 京发改[2019]569号 | 2019/4/25 | |
| 28 | 天津市 | Ⅱ | 0 | 0 | 0 | 津党发[2018]39号 | 2019/1/4 | |
| 29 | 陕西省 | Ⅱ | 0 | 0 | 0 | 陕财税[2019]26号 | 2020/1/10 | |
更新时间:2025年5月6日
单位:万元
第二类IVD注册证变更(许可事项变更)办理依据
| 文件名称 | 文号 |
|---|---|
| 《医疗器械监督管理条例》 | 650号文件 |
| 《体外诊断试剂注册与备案管理办法》 | 市场监督管理总局令第48号 |
| 《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》 | 总局公告2014年44号 |
| 食品药品监管总局关于印发境内第二类医疗器械注册审批操作规范的通知 | 食药监械管〔2014〕209号 |
第二类IVD注册证变更(许可事项变更)服务周期
立项阶段
预算、合同、考虑期,1个月。
受理前资料准备
资料提供,视客户情况而定 1个月
*如需:产品检测,视产品情况有所变化。 *平均3个月
*如需:临床实验不可与检测并行,临床应单独核算时间。 *至少6个月
变更资料编制(可与检测或临床并行。) 1个月
受理后
CFDA法定消耗预算5个月。(98工日,20工日/月,不计节假) 至少5个月
*发补(如适用):1、发补资料准备时限0~12个月视产品递交的申报资料情况而定。 *平均6个月
*发补(如适用):2、发补技术评审时间预计消耗3个月(60工作日) *3个月
*如需:体系考核,注册受理后,额外30工作日 *1.5个月
预算合计
无需重新检测、临床、体考、发补 预算平均8个月
第二类IVD注册证变更(许可事项变更)相关服务
| 许可事项变更资料汇编服务 | 汇编资料申报服务 |
| 省药监局跑腿代办服务 | 延伸:ivd临床试验服务 |
| 延伸:GMP年度辅导服务 | 延伸:二类IVD产品注册服务 |

立即咨询
 最新文章
最新文章 2026-01-25
2026-01-25 2026-01-24
2026-01-24 2026-01-23
2026-01-23 2026-01-22
2026-01-22 2026-01-21
2026-01-21六年
医疗器械服务经验
-
多一份参考,总有益处
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台
- 在线咨询











 豫公网安备 41010202003160号
豫公网安备 41010202003160号 
