
医疗器械模拟GMP飞行检查服务(不含整改)
经常关注国家及地方药品监督管理局的你,是不是也已经察觉到国家食品药品监管部门对医疗器械生产企业的监管已从事前监管逐步转变为加强事中事后监管,对企业的日常跟踪检查、...
服务价:¥电议
好评系数:
经常关注国家及地方药品监督管理局的你,是不是也已经察觉到国家食品药品监管部门对医疗器械生产企业的监管已从事前监管逐步转变为加强事中事后监管,对企业的日常跟踪检查、飞行检查已成为常态,省、市食品药品监管部门对每次飞行检查的结果都必须在各自网站上给予公布,如企业存在违规、违法问题,被停产整改、生产许可证被收回或撤销,将严重影响企业声誉,使企业承担巨大经济损失。飞检时代来临,您的企业准备好了吗?
如何应对医疗器械飞检?思途模拟飞检服务如下:
1、在项目的前期,只与公司的高层或者质量管理人员联系,模拟飞行检查的信息和日程不会提前告知公司的质量和生产部门,以保证飞行检查模拟的真实性和有效性。
2、由思途选定合适的时间对企业的GMP运行体系进行飞行检查。
3、思途将根据企业的特点和需求,安排具有丰富经验的咨询师及药监部门合作老师组成“模拟飞检”小组,必要时邀请国内外知名专家加入检查小组。
4、针对检查结果和企业的特点定制有针对性的整改方案。(本服务不包含整改,如有需求,需具体情况具体分析。)
5、根据检查中暴露的问题对人员进行有效的培训。
6、持续跟踪整改情况,确保整改的有效性。
7、根据首次模拟飞行检查的结果、整改情况以及企业的特点,不定期进行再次模拟飞行检查,评估整改的有效性和持续性。
模拟飞行检查服务的关注重点
在模拟飞行检查之前,我们将重点调研并与工厂有关人员讨论以下内容:
1、工厂生产的品种和剂型;
2、工厂各个品种和剂型的产量;
3、工厂年度生产概况;
4、产品投诉和不良反应的历史数据;
5、工厂和其他类似工厂最近接受国家局检查的审计缺陷;
6、客户希望重点审计的品种和范围。
在模拟飞行检查过程中,我们将重点关注以下内容:
1、数据完整性:重点关注实验室数据完整性。
2、计算机化系统的管理:包括QC和生产中涉及的计算机化系统。
3、工艺一致性:“注册工艺-工艺规程-记录-实际执行”的工艺一致性。
4、物料管理:差错、混淆、交叉污染的控制。
5、物料平衡:“仓储-生产”物料平衡管理。
6、检验的一致性:“检验方法-药典-质量标准-检验记录-实际操作”的一致性。
7、污染与交叉污染的控制:物料、生产、实验室污染与交叉污染的管控。
8、确认与验证:生产设备、公用系统、QC设备/仪器、工艺的验证与确认。
9、无菌保证的效果:无菌操作和无菌保证。
10、质量管理:典型质量保证管理程序的执行有效性。
11、人员培训:人员培训效果的考察。
12、其他方面:涉及到的其他方面。
医疗器械模拟飞检服务流程
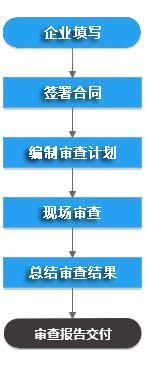
备注:
本项目不含整改辅导。如需整改辅导,请移步。
医疗器械模拟飞检收费标准
官方不收取任何费用。
医疗器械模拟飞检项目由思途下属企业认证部独立承担,模拟药监老师下厂飞行检查时可能提出的问题和检查厂区目前存在的问题。模拟飞行检查,思途只适当收取服务费。
医疗器械模拟飞检办理依据
| 文件名 | 发布文号 | 发布日期 | 实施日期 | 要求 |
|---|---|---|---|---|
| 医疗器械生产质量管理规范执行有关事宜的通告 | 2014年15号 | 2014年09月05日 | 2014年10月01日 | 新增三类器械、迁移或新增场地的应当符合“规范” |
| 2016年01月01日 | 所有三类生产企业都应当符合“规范” | |||
| 2018年01月01日 | 全类别生产企业都应当符合“规范” | |||
| 解决药品注册申请积压实行优先审评审批的意见 | 2016年19号 | 2016年02月05日 | 即日 | 三类企业全面自查,各省、自治区、直辖市食品药品监督管理部门组织实施检查。整改后仍不符合的,按照《医疗器械监督管理条例》第六十七条进行处罚。 |
| 印发医疗器械生产质量管理规范现场检查指导原则等4个指导原则的通知 | 食药监械监〔2015〕218号 | 2015年09月25日 | 即日 | 医疗器械生产质量管理规范现场检查指导原则(一般) |
| 医疗器械生产质量管理规范无菌医疗器械现场检查指导原则 | ||||
| 医疗器械生产质量管理规范植入性医疗器械现场检查指导原则 | ||||
| 医疗器械生产质量管理规范体外诊断试剂现场检查指导原则 | ||||
| 印发医疗器械生产质量管理规范定制式义齿现场检查指导原则的通知 | 食药监械监〔2016〕165号 | 2016年12月21日 | 即日 | 医疗器械生产质量管理规范定制式义齿现场检查指导原则 |
| 第一类、第二类医疗器械生产企业实施医疗器械生产质量管理规范有关工作的通知 | 食药监办械〔2017〕120号 | 2017年09月01日 | 即日 | 落实2014年第15号通告要求,继续检查三类企业,督促一、二类企业。 |
| 2018年01月01日 | 所有医疗器械生产企业均应当符合《规范》要求。 |
医疗器械模拟飞检服务周期
现场至少3个工作日,如有需要详谈。
医疗器械模拟飞检相关服务
| 飞检不符合项实例讲解 | 飞检迎审须知培训 |
| 企业自查要点培训 | 报告检查,提出意见。 |

立即咨询
 最新文章
最新文章 2026-01-25
2026-01-25 2026-01-24
2026-01-24 2026-01-23
2026-01-23 2026-01-22
2026-01-22 2026-01-21
2026-01-21六年
医疗器械服务经验
-
多一份参考,总有益处
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台
- 在线咨询











 豫公网安备 41010202003160号
豫公网安备 41010202003160号 