
第二类医疗器械注册变更(许可事项变更)服务
根据《医疗器械注册管理办法》的规定,已注册的第二类医疗器械,医疗器械注册证及其附件载明的内容发生变化,注册人应当向原注册部门申请注册变更,并按照相关要求提交申报资...
服务价:¥电议
好评系数:
根据《医疗器械注册与备案管理办法》的规定,已注册的第二类医疗器械,医疗器械注册证及其附件载明的内容发生变化,注册人应当向原注册部门申请注册变更,并按照相关要求提交申报资料。 产品名称、型号、规格、结构及组成、适用范围、产品技术要求、进口医疗器械生产地址等发生变化的,注册人应当向原注册部门申请许可事项变更。二类医疗器械注册证许可事项变更,搞不定?我帮您!
二类医疗器械注册许可事项变更办理资料
1、《医疗器械注册证许可事项变更申请表》;
2、证明性文件:营业执照等;
3、注册人关于变更情况的声明;
4、原医疗器械注册证及附件复印件、历次医疗器械注册变更文件复印件;
5、变更申请项目申报资料要求(根据具体情况提交以下文件):
(1)产品名称变化的对比表及说明;
(2)产品技术要求变化的对比表及说明;
(3)型号、规格变化的对比表及说明;
(4)结构及组成变化的对比表及说明;
(5)产品适用范围变化的对比表及说明;
(6)注册证中“其他内容”变化的对比表及说明。
6、与产品变化相关的安全风险管理报告;
7、变化部分对产品安全性、有效性影响的资料;
8、针对产品技术要求变化部分的注册检验报告;
9、符合性声明。
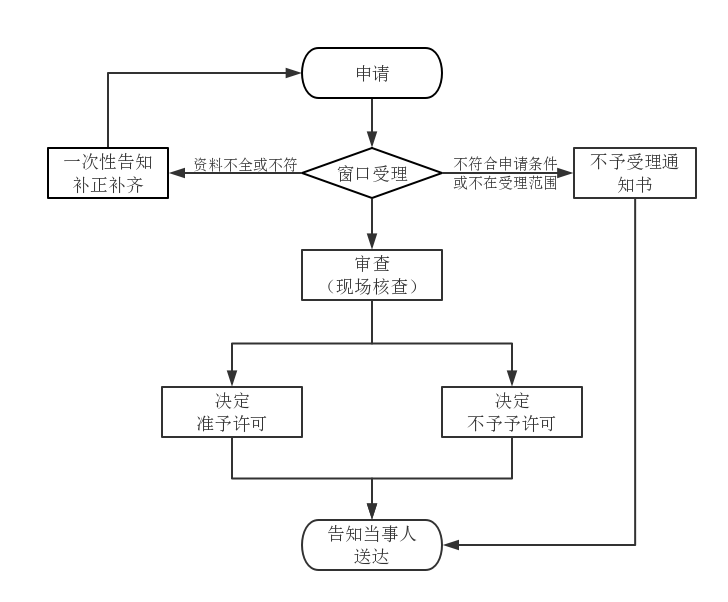
第二类医疗器械注册许可事项变更办理流程
二类医疗器械注册变更客户咨询问题整编
1、已取得注册证二类器械在销售的产品,要变更外壳颜色(仅颜色),有需要走什么流程的吗?需要注册变更吗?
答:外壳颜色变更不用做医疗器械注册变更,企业内部资料变更即可。
2、如果在北京市药监局变更医疗器械产品型号,需要怎么样的一个程序呀?办理变更程序是否简单?
答:办理变更相当于重新注册。增加型号属于许可事项变更,要是减型号属于登记事项变更。
3、已注册二类产品,在同一个注册单元内增加规格型号,还需要缴变更注册费吗?
答:增加型号属于许可事项变更,部分省份对二类医疗器械注册证许可事项变更收取变更费用,详见下方收费标准。
4、第二类医疗器械许可事项变更,省局还要现场核查注册质量体系吗?如果是生产场地变更呢?
答:许可事项变更一般不来,大部分省份不来。生产场地变更不是许可事项,这个是登记事项。在注册证时,这个是需要现场体考的。
第二类医疗器械注册变更(许可事项变更)服务流程
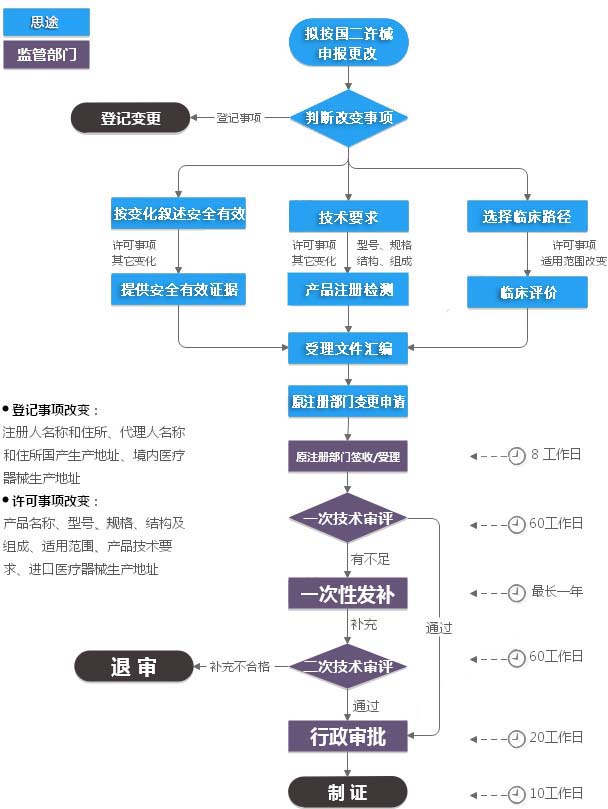
备注
* 产品名称、型号、规格、结构及组成、适用范围、产品技术要求、进口医疗器械生产地址等发生变化的,注册人应当向原注册部门申请许可事项变更。
* 注册人名称和住所、代理人名称和住所发生变化的,注册人应当向原注册部门申请登记事项变更;境内医疗器械生产地址变更的,注册人应当在相应的生产许可变更后办理注册登记事项变更。
第二类医疗器械注册变更(许可事项变更)收费标准
| 主管部门 | 管理类别 | 首次注册 |
注册变更 (许可事项变更) |
延续注册 (五年一次) |
相关文件 | 实施日期 | ||
|---|---|---|---|---|---|---|---|---|
|
省 局 |
1 | 福建省 | Ⅱ | 5.77 | 2.42 | 2.39 |
闽发改服价函〔2021〕 361号 |
2021/9/1 |
| 2 | 江西省 | Ⅱ | 3.8272 | 1.602 | 1.587 | 赣发改价管〔2023〕670号 | 2023/11/1 | |
| 3 | 上海市 | Ⅱ | 2.3005.5 | 0.9628.5 | 0.9555 | 沪药监公告﹝2024﹞1号 |
2024年4月1日 (截止25年12月31日) |
|
| 4 | 海南省 | Ⅱ | 4.067 | 1.6856 | 1.6709 | 琼发改收费〔2021〕424号 | 2021/6/15 | |
| 5 | 山东省 | Ⅱ | 4.6 | 1.92 | 1.9 | 鲁发改成本[2022]761号 |
2022/9/30 (截止25年10月7日) |
|
| 6 | 安徽省 | Ⅱ | 4.5045 | 1.4651 | 1.0395 | 皖发改价费函〔2024〕440号 |
2023/12/29 (截止26年1月1日) |
|
| 7 | 浙江省 | Ⅱ | 4.6011 | 1.5405 | 1.5288 | 浙药监械[2023]2号 | 2023/8/31 | |
| 8 | 山西省 | Ⅱ | 1.26 | 0.48 | 0.48 | 晋发改收费发〔2023〕361号 | 2023/9/18 | |
| 9 | 云南省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 10 | 河北省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 11 | 江苏省 | Ⅱ |
5.915 小微企业免征 |
2.471 | 2.457 | 苏发改收管发[2019]91号 | 2019/2/13 | |
| 12 | 宁夏 | Ⅱ | 0.75 | 0.325 | 0 | 宁发改价格(调控)函〔2025〕53号 | 2025/2/19 | |
| 13 | 黑龙江 | Ⅱ | 3.312 | 1.403 | 1.38 | 黑发改价格〔2020〕712 号 | 2024/6/10 | |
| 14 | 广东省 | Ⅱ | 5.726 | 2.394 | 2.38 | 粤发改价格函〔2019〕666号 | 2019/2/25 | |
| 15 | 湖南省 | Ⅱ | 5.04 | 2.114 | 2.1 | 湘发改价费规〔2024〕416号 | 2024/6/10 | |
| 16 | 四川省 | Ⅱ | 3.90 | 1.60 | 1.60 | 川发改价格〔2024〕585号 |
2024/12/1 (截止2029年12月1日) |
|
| 17 | 贵州省 | Ⅱ | 2.145 | 0.88 | 0.88 | 黔发改价格〔2024〕787号 | 2024/12/31 | |
| 18 | 广西 | Ⅱ | 2.0187 | 1.264 | 0 | 桂发改价费函〔2024〕1327号 | 2024/6/11 | |
| 19 | 辽宁省 | Ⅱ | 5 | 2.1 | 2.1 | 辽药监告〔2023〕70号 | 2023/7/20 | |
| 20 | 吉林省 | Ⅱ | 0 | 0 | 0 | 吉政发〔2020〕4号 | 2020/2/8 | |
| 21 | 湖北省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 22 | 河南省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 23 | 重庆市 | Ⅱ | 0 | 0 | 0 | 渝府办发〔2019〕56号 | 2019/5/15 | |
| 24 | 甘肃省 | Ⅱ | 0 | 0 | 0 | / | / | |
| 25 | 新疆 | Ⅱ | 0.28 | 0.24 | 0.12 | 新发改收费〔2024〕158 号 | 2024/4/18 | |
| 26 | 内蒙古 | Ⅱ | 0 | 0 | 0 | 内发改费字〔2019〕773号 | 2019/9/17 | |
| 27 | 北京市 | Ⅱ | 0 | 0 | 0 | 京发改[2019]569号 | 2019/4/25 | |
| 28 | 天津市 | Ⅱ | 0 | 0 | 0 | 津党发[2018]39号 | 2019/1/4 | |
| 29 | 陕西省 | Ⅱ | 0 | 0 | 0 | 陕财税[2019]26号 | 2020/1/10 | |
更新时间:2025年5月6日
单位:万元
第二类医疗器械注册变更(许可事项变更)办理依据
| 文件名称 | 文号 |
|---|---|
| 《医疗器械监督管理条例》 | 650号文件 |
| 《医疗器械注册管理办法》 | 局令4号 |
第二类医疗器械注册变更(许可事项变更)服务周期
立项阶段
预算、合同、考虑期,约2个工作日。
受理前资料准备
产品添加新型号,需考虑检测。平均消耗6个月,视产品情况有所变化。(如无强标更新,则可免除检测。)
如需精算请联络思途。(免临床目录产品除外。)
注册变更资料编制可与检测并行,资料编写大致15个工作日。
省局受理期限,在5个工作日。
受理后
省局法定办结时限在3个月。(93工日,不计节假。)
发补时限0~2个月,考虑平均时间1个月。视变更资料具体情况而定。
预算合计
第二类医疗器械注册许可事项变更代办服务,预计完成在4.5~10.5个月。
第二类医疗器械注册变更(许可事项变更)相关服务
| 注册变更申报资料编写服务 | 变更发补资料编写服务 |
| 药监跑腿(直到下证)服务 | 延伸:医疗器械临床试验服务 |
| 延伸:GMP年度辅导服务 | 延伸:二类医疗器械注册服务 |

立即咨询
 最新文章
最新文章 2026-01-25
2026-01-25 2026-01-24
2026-01-24 2026-01-23
2026-01-23 2026-01-22
2026-01-22 2026-01-21
2026-01-21十年
医疗器械服务经验
-
多一份参考,总有益处
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台
- 在线咨询











 豫公网安备 41010202003160号
豫公网安备 41010202003160号 