有源医疗器械加速老化试验效期验证及使用期限验证流程
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有
来源:医疗器械注册代办 发布日期:2025-09-03 阅读量:次
正在历经十年来堪称最为巨大变革进程之中的医疗器械注册,2025 年它将会成为那行业发展方面具备关键意义的分水岭。由于新一轮政策调整所形成的窗口期即将要关闭,然而许多企业此刻依旧处于观望的状态,他们却浑然不知新确立的注册规则会以一种彻底的方式去改变整个市场格局。现在倘若能够立即展开行动,说不定还可以抓住那最后的机遇,要是稍微晚一步,极有可能会面临那些全新出现的挑战。

企业的命运实则将受注册路径选择这种关键因素所左右,须知在 2025 年之际会严格执行的产品分类新规,致使大量产品都不得不面临注册路径方面的相应调整,这其中原本依照二类进行管理的产品有可能会被重新划入三类范畴之内,也就意味着需开展临床试验,所以建议企业应当即刻对产品开展重新分类评估工作,抓住这最后的备案制难得机会,以免不慎陷入临床评价所带来的困境当中。
自2025年起始,鉴于临床评价所发生的质的转变,致使同品种比对路径呈现出收窄态势,这便要求企业针对提供更为充分的对比数据,而此等数据所有均需源自中国人群,境外数据仅能起着参考之用,这就意味着那些一直以来依赖进口数据的企业,必须重新对临床评价策略予以规划,尽快将国内临床数据收集工作加以启动。
| 重大变化 | 最后时机 | 应对策略 |
|---|---|---|
| 分类规则调整 | 2025年6月前 | 立即进行产品重新分类 |
| 临床数据要求 | 2025年3月前 | 启动国内临床数据收集 |
| 电子申报强制实施 | 2025年1月1日起 | 完成系统升级和人员培训 |
| 体系核查新标 | 2025年9月前 | 提前进行模拟核查 |
从 2025 年 1 月 1 日这个特定的时间节点起,电子申报便成为了申报工作所能依赖的唯一通道,全面推行电子申报这一举措实施后,纸质材料将不再会被接收,鉴于此情形,企业不但要对全新系统的操作做到熟悉,而且还需要改变以往传统的文档准备方式,基于这样的情况,建议应立即开展针对该系统的培训以及试运行工作,以免因操作方面出现的各类问题而耽误了至关重要的申报进度。
面临堪称最为严峻考验的质量管理体系,在 2025 年的时候将会被推行关于体系核查的新标准,使飞行检查成为一种被常态化的方式,尤其对数据真实性以及完整性予以特别关注,因为任何记录出现缺失的状况极有可能致使产生严重后果,所以建议企业应当立即着手启动数据治理方面工作并去建立具备电子化特征的质量记录系统,进而确保所有数据都处于可被追溯这样一种状态。
注册时限方面所呈现出的两极分化状况,是由于简单产品的审批以一种相对提速的方式进行,与此同时复杂产品的要求被制定得更为严格,而预计在 2025 年即将实施的分级审评制度,其中低风险产品能够享有快速通道这一便利条件,与之相对的是高风险产品的审批将会被执行更为严格的标准,基于如此情形,给到企业的建议便是依据产品所具备的特性,对适宜的申报策略予以斟酌选择,从而避免陷入盲目追求快速通道这一不恰当行为。
尽管当下行动仍不至于为时已晚然而时间已处于极度紧迫之态势,在此种情形下建议企业即刻成立专项性质的工作组针对注册事宜制定出详尽细致的规划,而其中的重点应放在妥善做好产品分类予以确认、对临床评价策略作出适当调整、将电子申报所需各项准备到位以及使质量体系实现有效升级等方面,只有牢牢抓住所剩不多的最后的政策窗口期才有可能于2025年即将来临的行业大规模洗牌当中占据领先优势。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
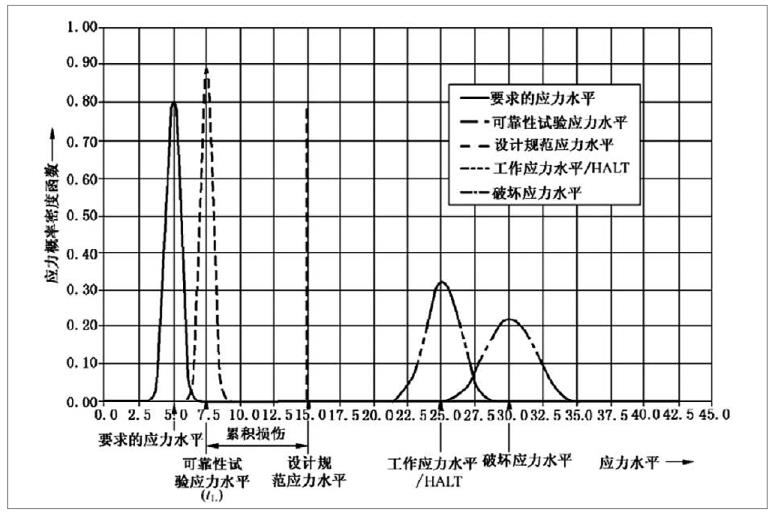
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有

润滑剂类产品在美国根据产品预期用途的不同主要分为人体润滑剂和患者润滑剂:其中,人体润滑剂主要成分为水、丙二醇、羟乙基纤维素、苯甲酸、卡波姆、氢氧化钠等,作用于生殖

中国能排进世界十大医疗器械制造强国吗?暂时还不能,因为排进前十的国家都有许多知名械企和世界级医疗器械巨头;而中国比较出名的可能只有迈瑞了,其他械企仍需努力了。下面

本文介绍了欧盟医疗器械新法规MDR相比于将替代的MDD法规的几点新增要求。建议收藏学习。明年5月份起,Medical Devices Regulation(MDR)(2017/745/ EU)将替代原本的Medical Devices Directive (93

生物材料在疾病治疗和医疗保健中发挥了重要的作用,按材料性质,生物材料可分为惰性材料与可降解性材料两种,目前生物材料的发展呈现出由惰性向可降解性(水解和酶降解)转变的趋

医疗器械注册费是行政性收费,按照注册单元收取,部分省份不收取医疗器械注册费用,绝大部分省份还是收取的。本篇文章统计了截止到2022年1月5日各地医疗器械注册收费标准。
可吸收高分子材料介绍,及其在植入医疗器械中的应用。1、植入产品的定义国家食品药品监督管理局《医疗器械分类规则》(局令第15号)第八条中对“植入器械”的定义为:任何借助

一个产品带有CE 标志(标记) 也就意味着其制造商宣告:该产品符合欧洲的健康、安全、与环境保护之相关法律中所规定 的基本要求。因而该产品是对:使用者(译者注:人)、宠物(

2021年2月5日,湖南省药监局分别与湖南省计量检测研究院、湖南新领航检测技术有限公司、湖南普瑞玛药物研究中心有限公司、深圳华通威国际检验有限公司、南德认证检测(中国)有限公
为服务中国(广东)自由贸易试验区和科创中心国家战略,全面贯彻党的十九大精神和总书记对广东重要指示批示精神,深化供给侧结构性改革,建设健康中国,奋力实现“四个走在全
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台