有源医疗器械加速老化试验效期验证及使用期限验证流程
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有
来源:医疗器械注册代办 发布日期:2025-10-13 阅读量:次
国家药品监督管理局医疗器械技术审评中心(CMDE)近日发布了2025年第9号创新医疗器械特别审查申请审查结果公示。本次公示日期为2025年10月10日至10月23日,公示期内共有八款创新医疗产品被创新医疗器械审查办公室组织专家审查后,拟同意进入特别审查程序,即业界常说的“绿色通道”。这一动向清晰地反映了当前医疗器械产业前沿的创新热点与研发趋势。对于关注医疗器械注册领域的企业和专业人士而言,及时了解这些通过初审的产品信息,不仅能够把握技术发展方向,更能深入理解监管机构对于“创新”内涵的最新界定标准,为自身产品的研发与注册策略提供有价值的参考。
从本次公示的八款产品名单来看,其技术领域分布广泛且均指向临床需求的精准解决。产品涵盖了高端医学影像设备如单光子发射及X射线计算机断层成像系统,高端治疗设备如眼科飞秒激光治疗机和聚焦超声治疗系统,以及前沿的手术控制系统与植入器械如结构性心脏病手术控制系统和颈动脉双层密网支架。此外,在体外诊断和新型生物材料领域也有代表性产品入围,例如用于原发性免疫缺陷病筛查的基因检测试剂盒以及免缝生物羊膜。这些产品普遍具有技术集成度高、设计理念新颖、旨在解决特定临床难点的共同特征。它们的集中亮相标志着我国医疗器械研发正从跟跑向并跑乃至部分领域的领跑转变,创新质量持续提升。
进入创新医疗器械特别审查程序意味着产品研发获得了官方的初步认可,并能享受到一系列政策红利。根据《创新医疗器械特别审查程序》,进入该通道的产品将在注册申报过程中获得CMDE的优先审评待遇,审评机构会早期介入并指定专人进行交流指导,这能有效缩短注册申报的整体时间周期。需要指出的是,进入绿色通道并不等同于产品已经满足了最终获批上市的全部安全性与有效性要求。它更像是一张宝贵的“快速通行证”,为后续更为关键的技术审评工作奠定了良好基础。申请人依然需要严格按照法规要求,扎实完成产品研发、性能验证、临床评价等关键环节,最终提出正式的注册申请。
对于所有进入特别审查程序的产品申请人而言,接下来的工作重点将转向与监管机构的深度沟通和高质量注册资料的准备。公示期结束后若无重大异议,这些产品便正式进入特别审查阶段。申请人应充分利用CMDE提供的专人负责、科学审查的原则,就关键技术参数、临床方案设计、统计方法等核心问题与审评老师保持积极、坦诚的沟通。整个过程中,一份科学、严谨、完整且逻辑清晰的注册申报资料是成功通过技术审评的基石。这要求企业不仅要有强大的研发能力,更需要具备深厚的注册法规理解和文档撰写能力,能够将复杂的技术信息转化为审评人员易于理解和评估的标准化语言,从而顺利走完从创新概念到市场产品的最后一公里。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
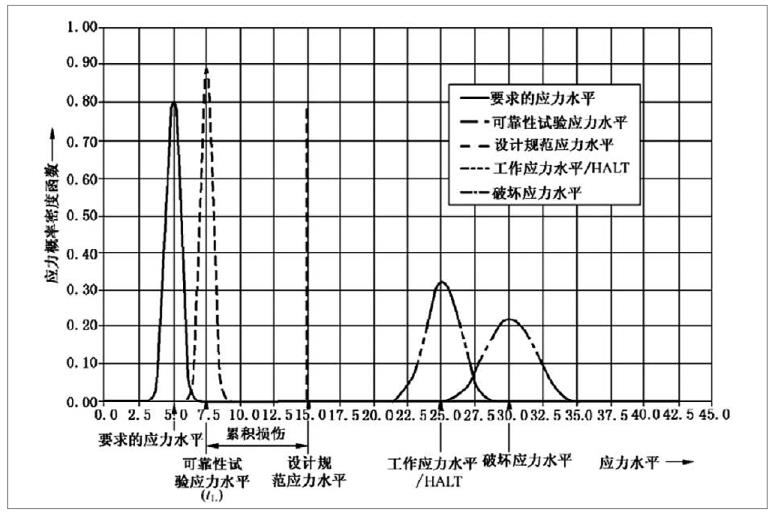
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有

随着国家医疗改革的不断深入,使得综合性大中型医疗机构的中心实验室对自动化系统有了新的要求,为了简化检测流程,提高检测效率,保证数据准确度等,中心实验室对集中化诊断

润滑剂类产品在美国根据产品预期用途的不同主要分为人体润滑剂和患者润滑剂:其中,人体润滑剂主要成分为水、丙二醇、羟乙基纤维素、苯甲酸、卡波姆、氢氧化钠等,作用于生殖

中国能排进世界十大医疗器械制造强国吗?暂时还不能,因为排进前十的国家都有许多知名械企和世界级医疗器械巨头;而中国比较出名的可能只有迈瑞了,其他械企仍需努力了。下面

FDA于2020.12.11发布了关于简短(Abbreviated) 510(k)申请的相关产品指南,该指南是在遵守“基于安全有效性途径”这一前提下编制提出的。在这个框架下,申请人若计划使用安全有效性途径提交

本文介绍了欧盟医疗器械新法规MDR相比于将替代的MDD法规的几点新增要求。建议收藏学习。明年5月份起,Medical Devices Regulation(MDR)(2017/745/ EU)将替代原本的Medical Devices Directive (93

生物材料在疾病治疗和医疗保健中发挥了重要的作用,按材料性质,生物材料可分为惰性材料与可降解性材料两种,目前生物材料的发展呈现出由惰性向可降解性(水解和酶降解)转变的趋

医疗器械注册费是行政性收费,按照注册单元收取,部分省份不收取医疗器械注册费用,绝大部分省份还是收取的。本篇文章统计了截止到2022年1月5日各地医疗器械注册收费标准。
可吸收高分子材料介绍,及其在植入医疗器械中的应用。1、植入产品的定义国家食品药品监督管理局《医疗器械分类规则》(局令第15号)第八条中对“植入器械”的定义为:任何借助

一个产品带有CE 标志(标记) 也就意味着其制造商宣告:该产品符合欧洲的健康、安全、与环境保护之相关法律中所规定 的基本要求。因而该产品是对:使用者(译者注:人)、宠物(
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台