灭菌级和非灭菌级外科口罩区别
新冠疫情大流行,人们佩戴口罩抵御病毒成了一种常态,吃饭的时候和同事开玩笑,以后脱下口罩不知道会不会习惯。医用外科口罩外包装上通常标明灭菌级和非灭菌级,你知道两者的
来源:医疗器械注册代办 发布日期:2025-08-18 阅读量:次
我们有个带电源的医疗设备(有源器械),它上面有些零件(附件)是能拆下来反复用的,比如探头、手柄、导管啥的。用完之后,下次给新病人用之前,肯定得给它整干净消毒或者灭菌好。现在要报产品注册了,关于这些可重复用附件的消毒灭菌该怎么写资料,审评老师最关心啥?容易在哪儿栽跟头?

第一要紧的,就是说明书里必须写得明明白白、丁是丁卯是卯!绝对不能含糊!用户(医院消毒供应室或者操作护士)看了你的说明书,必须能毫不费劲地知道这个附件到底该怎么消毒/灭菌。具体要写清楚啥?首先,明确告诉人家用啥方法: 是拿消毒液泡着(化学消毒)?还是用高温高压蒸(压力蒸汽灭菌)?或者用低温的环氧乙烷、过氧化氢等离子体灭?其次,关键参数一个不能少: 如果用药水泡,用的是哪种消毒剂(比如邻苯二甲醛、含氯消毒剂,具体名字浓度都得写)?泡多久?泡的时候温度多少?配好的消毒液能用几次?如果是高温高压灭,温度设多少?压力多大?时间多长?干燥时间多久?如果是低温灭,气体浓度多少?作用时间?通风解析时间?这些数字都得是具体的范围或者确定值(比如“121°C,压力106.8 kPa,灭菌时间20分钟”),千万不能写“常规消毒灭菌”、“按医院标准操作”这种屁话!审评老师最恨这种模糊表述,肯定给你打回来补正!说明书就是用户的“操作手册”,写不清,人家操作错了,轻则附件坏得快,重则消毒不彻底传染病人,责任都是你的!
光说明书写清楚还不行,你得拿出实实在在的研究数据,证明你推荐的消毒灭菌方法真的管用、真的安全!这就是研究资料部分的核心。第一块,说说你为啥选这个方法: 是行业里常用的?还是你做了实验比较了几种方法发现这个最好?或者你这个附件材料特殊(比如怕高温、怕某种化学剂),只能选这个方法?得把理由讲充分。第二块,也是最重要的,拿出“消毒灭菌效果”的铁证: 简单说,就是证明按你说明书写的那个方法整一遍,确实能把附件的细菌病毒杀得干干净净!怎么证明?老老实实按标准做灭菌效果验证!比如你说是灭菌(要求无菌),那就得按 GB 18278(湿热灭菌)、GB 18279(环氧乙烷灭菌) 这类标准的要求,做灭菌挑战试验,用最难杀死的细菌芽孢(比如嗜热脂肪芽孢杆菌)来测试,证明按你的参数操作,能把这最顽强的芽孢都杀灭掉,而且得重复做够次数证明稳定可靠。如果是消毒(要求把病原微生物杀到安全水平),也得按相应的消毒标准(比如 GB 15981 )做效果验证。检测报告最好找有资质的第三方实验室出,自己做的也行,但数据要完整可信。第三块,证明你的附件“扛得住”: 你推荐的消毒灭菌方法,会不会把附件搞坏、搞变形、搞得不灵光了?这就是“耐受性研究”。怎么做?模拟最狠的情况! 比如你说明书说这附件能高温高压灭200次,那你就真按这个参数反复灭它200次(或者更多,加个安全余量),然后每次灭完都检查:附件外形变没变(裂了?变形了?)功能还好不好(还能正常工作吗?精度变没变?)材料老没老化(变脆了?掉渣了?)。特别是那些关键性能(比如带电极的探头阻抗、带传感器的精度),灭完必须测!最后拿出数据证明:灭够了你说的次数,这附件还是好好的,安全能用。耐受性不行,说明书里承诺的复用次数就得改少点!
最后,千万别想当然!得考虑实际用起来的情况。医院里的消毒设备五花八门,操作人员水平也参差不齐。你在实验室用顶级设备、完美操作做出来的效果,医院里不一定能达到。所以,研究时要有点“安全余量”: 比如你验证效果时,用的微生物挑战难度要比实际可能遇到的更高一点;做耐受性时,设定的参数条件(温度、压力、浓度)可以比说明书写的稍微严苛一点点(比如温度高个一两度,时间多个几分钟),或者消毒剂浓度配得稍微高点,这样万一医院操作有点小偏差,也不至于立刻失效或损坏。说明书里也要提醒关键风险: 比如“必须严格遵循参数操作,温度不得低于XX°C”,“使用XX消毒剂浸泡后必须用无菌水彻底冲洗”,“超过XX次灭菌后建议检查附件性能”… 这些警示语不能少。归根结底,你的研究资料和说明书,得让审评老师相信:按你写的这套方法,在真实的医院环境里,普通工作人员操作,也能稳定地把附件消毒/灭菌好,并且附件不会轻易坏掉,保证病人安全和你产品的可靠性!
总结划重点:
1、说明书参数要精确(方法、消毒剂/设备、时间、温度、压力…),拒绝模糊!
2、研究资料三件套:
(1)选方法的理由(为啥用这个不用那个?)
(2)消毒灭菌效果铁证(按标准做挑战试验,第三方报告更硬气)
(3)耐受性数据(灭够次数还完好?关键性能稳不稳?模拟最狠情况!)
3、考虑实际用,留点安全余量,说明书写好风险提示。 让审评老师相信你这套在真实世界也靠谱!

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

新冠疫情大流行,人们佩戴口罩抵御病毒成了一种常态,吃饭的时候和同事开玩笑,以后脱下口罩不知道会不会习惯。医用外科口罩外包装上通常标明灭菌级和非灭菌级,你知道两者的

根据《中华人民共和国传染病防治法》第七十八条的规定,消毒是指用化学、物理、生物的方法杀灭或者消除环境中的病原微生物。 在作用目的上,它是一种防病的产品,而不是

家庭中常用的餐巾纸、湿巾、婴幼儿纸尿裤、成人纸尿裤、纸尿布、隔尿垫、卫生巾、卫生护垫、化妆棉、消毒剂、空气消毒器械等都属于消毒产品。哪些产品需要办理消字号备案?哪

所谓的灭菌方式,是使用物理或者化学方法,破坏所有的微生物包括数量巨大且具有抵抗力的细菌芽孢。以下介绍下辐照灭菌、环氧乙烷(EtO)灭菌、湿热(蒸汽)灭菌、干热灭菌、低

相信多数有源器械企业来说,通过EMC检测都是挑战性,企业也很难具备符合条件的EMC摸底检测实验条件。很多企业都有类似经历,碰到有源医疗器械注册检验EMC不合格,怎么办呢?去解
第一类消毒产品:用于医疗器械的高水平消毒剂和消毒器械、灭菌剂和灭菌器械,皮肤/黏膜消毒剂,生物指示物、灭菌效果化学指示物;第二类消毒产品 :除第一类产品外的消毒剂、消
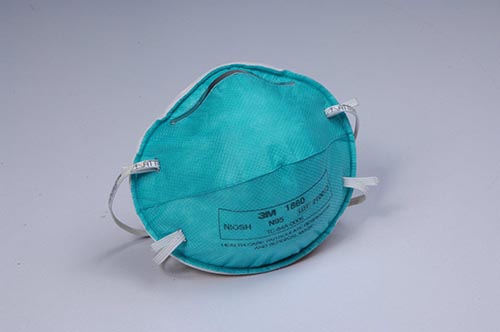
医用防护口罩与佩戴者面部具有良好的贴合性,可过滤空气中的微粒,阻隔飞沫、血液、体液、分泌物等的污染物,对非油性颗粒的过滤效率可达到95%以上,因此N95也属于医用防护口罩

消字号产品顾名思义就是消毒产品,主要用于杀灭或清除传播媒介上病原微生物,是卫生部为提高公共卫生质量而批准的一类产品,也就是说它不具有任何治疗效果。众所周知药品由于

消毒产品生产许可证

洁净室(Clean Room),亦称无尘车间、无尘室或清净室。洁净室的主要功能为室内污染控制,没有洁净室,污染敏感零件不可能批量生产。在FED-STD-2里面,洁净室被定义为具备空气过滤、
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台