海南博鳌乐城国际医疗旅游先行区临床急需进口药品带离先行区使用管理暂行办法(琼药监综〔2020〕3号)
《海南博鳌乐城国际医疗旅游先行区临床急需进口药品带离先行区使用管理暂行办法》已经3月24日海南博鳌乐城国际医疗旅游先行区领导小组会议审议通过,现印发给你们,请遵照执行
来源:医疗器械注册代办 发布日期:2025-06-24 阅读量:次

发布时间:2025-06-24
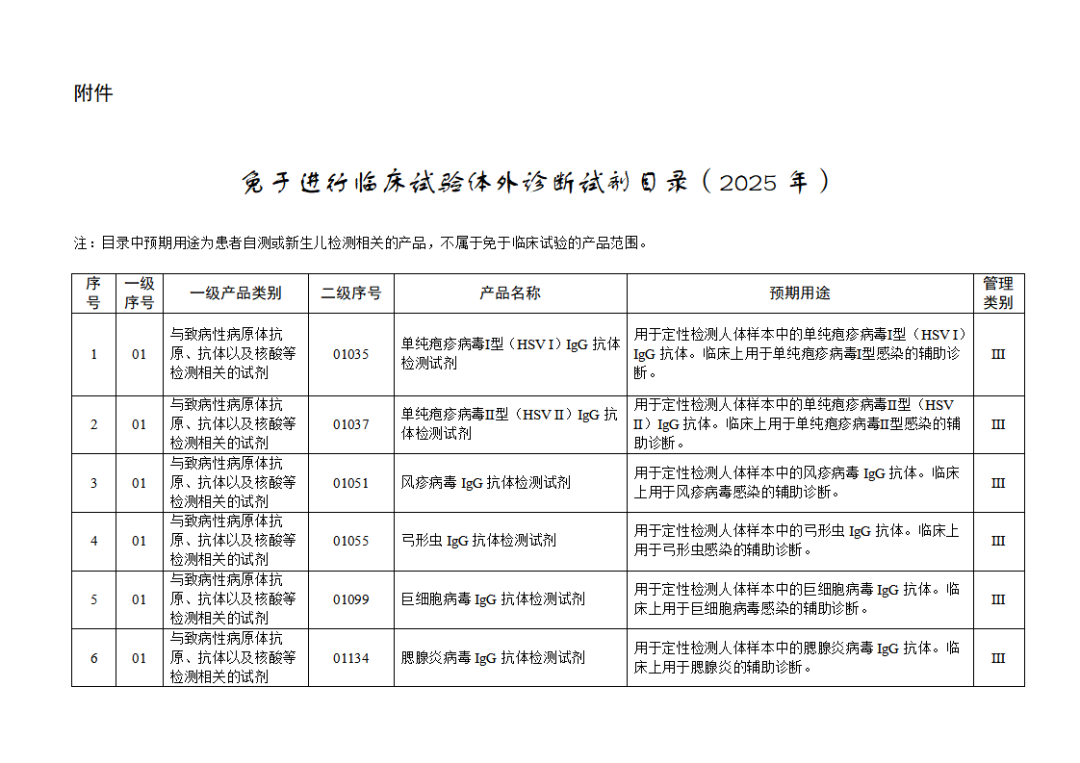
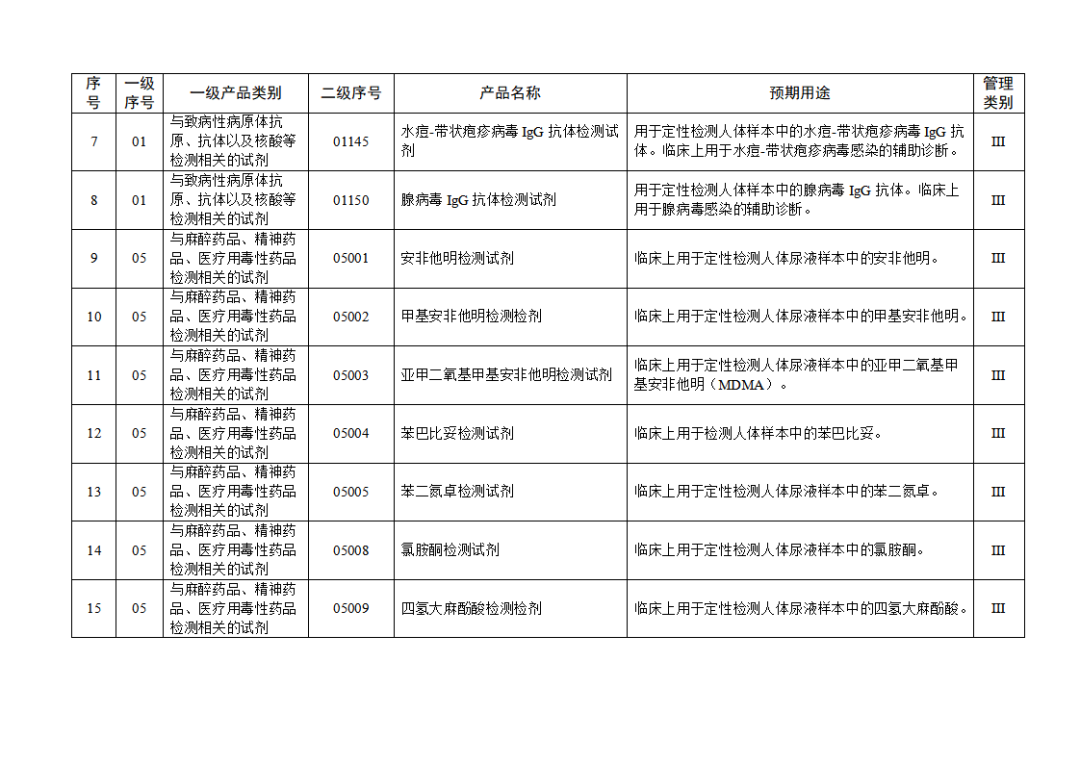
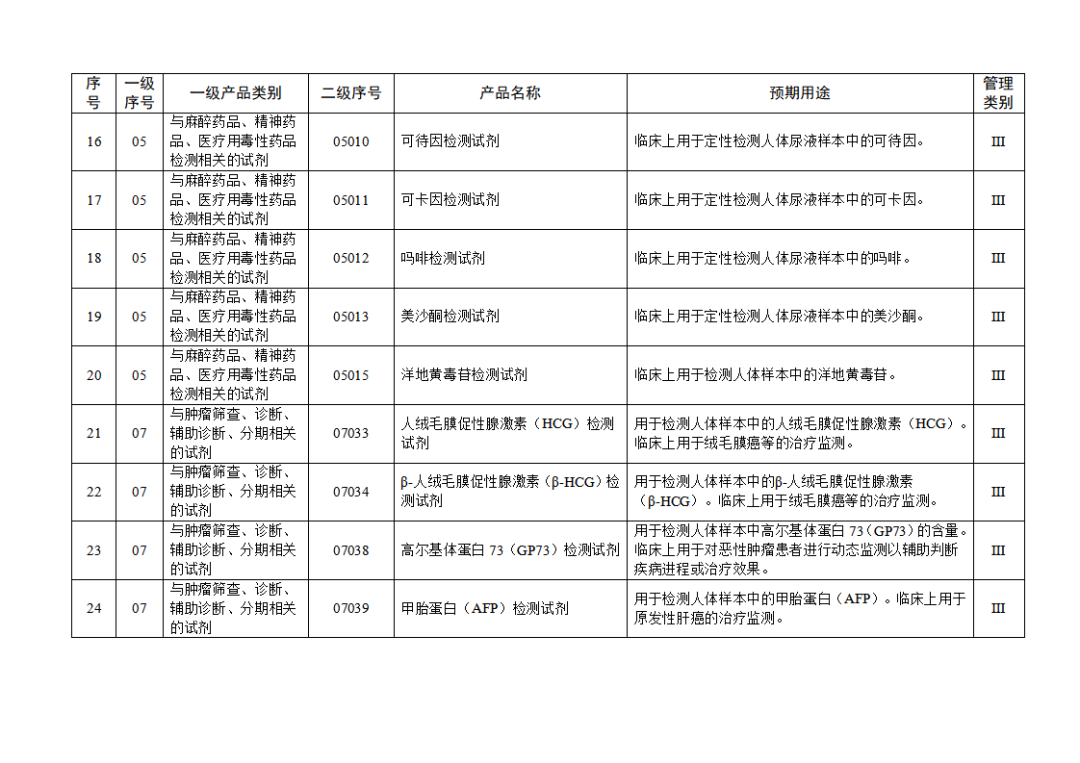
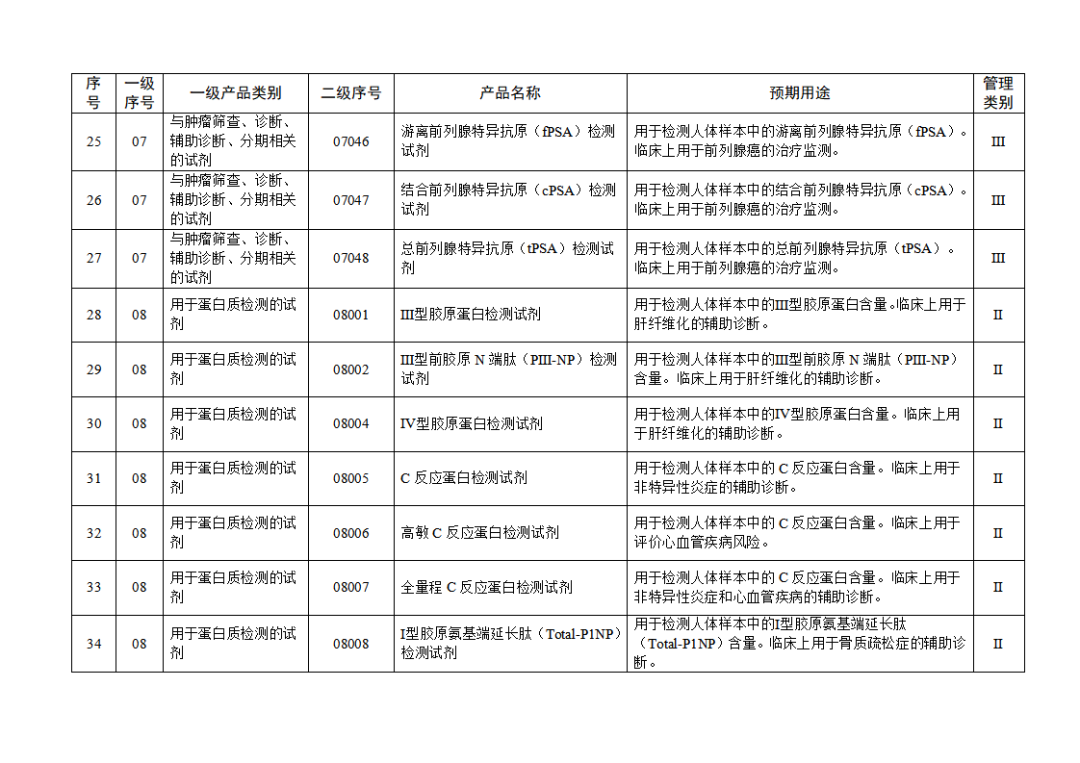
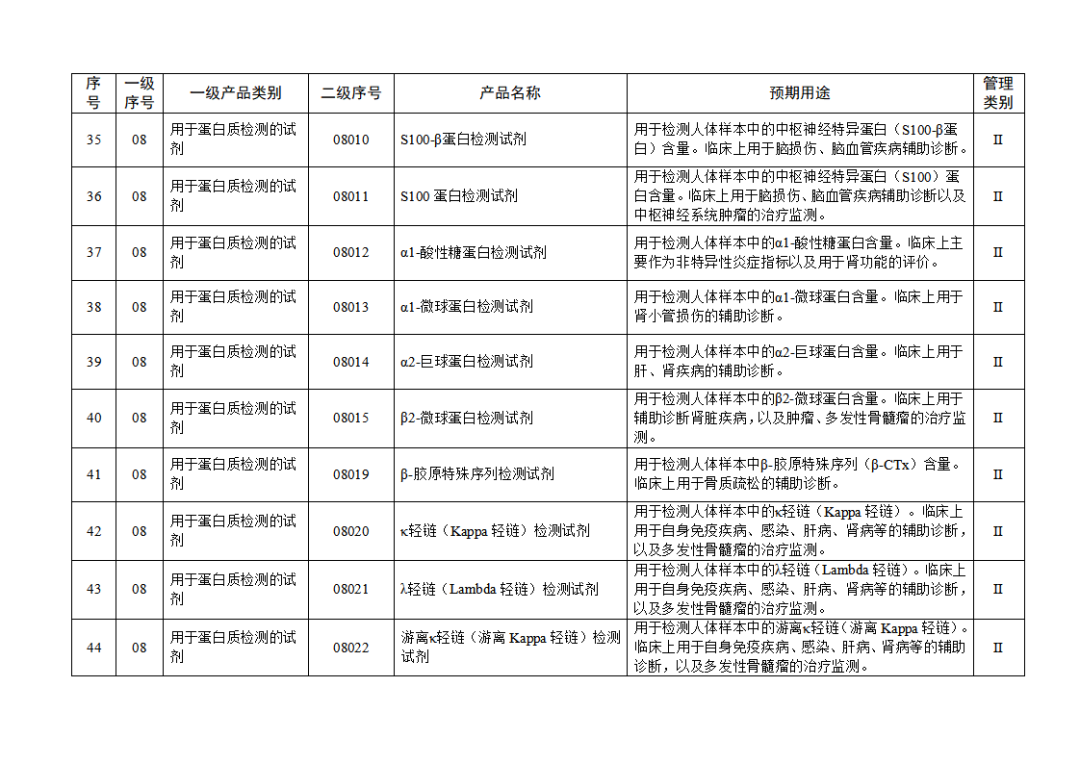
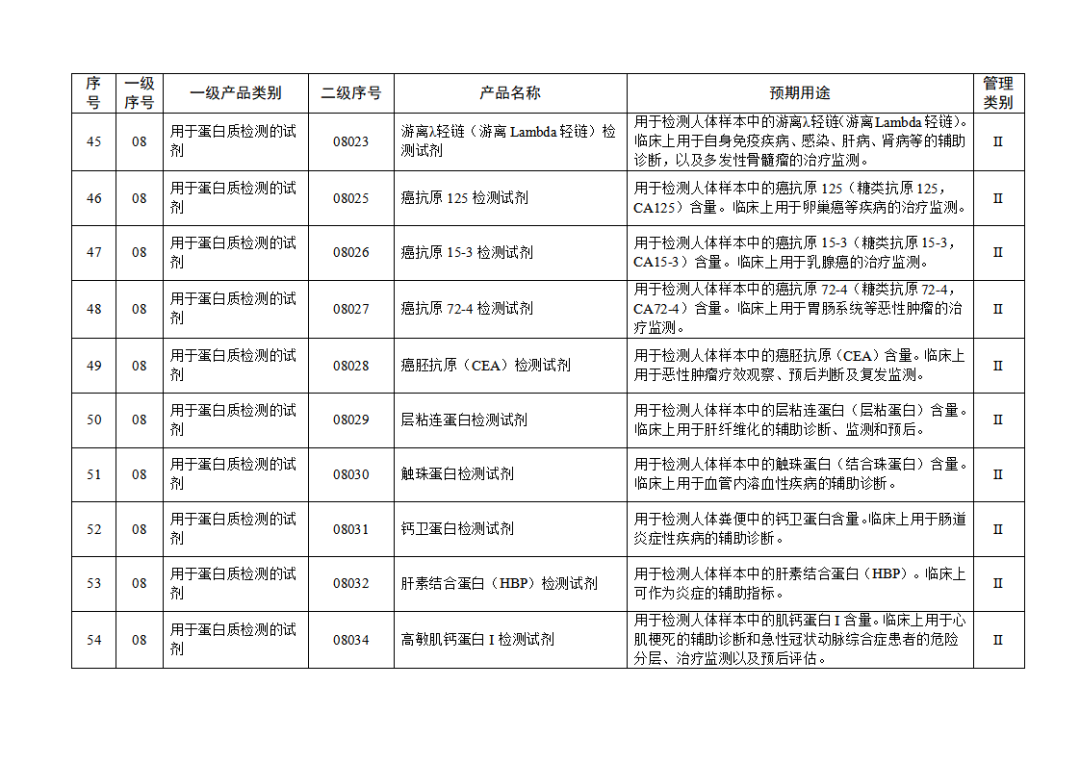
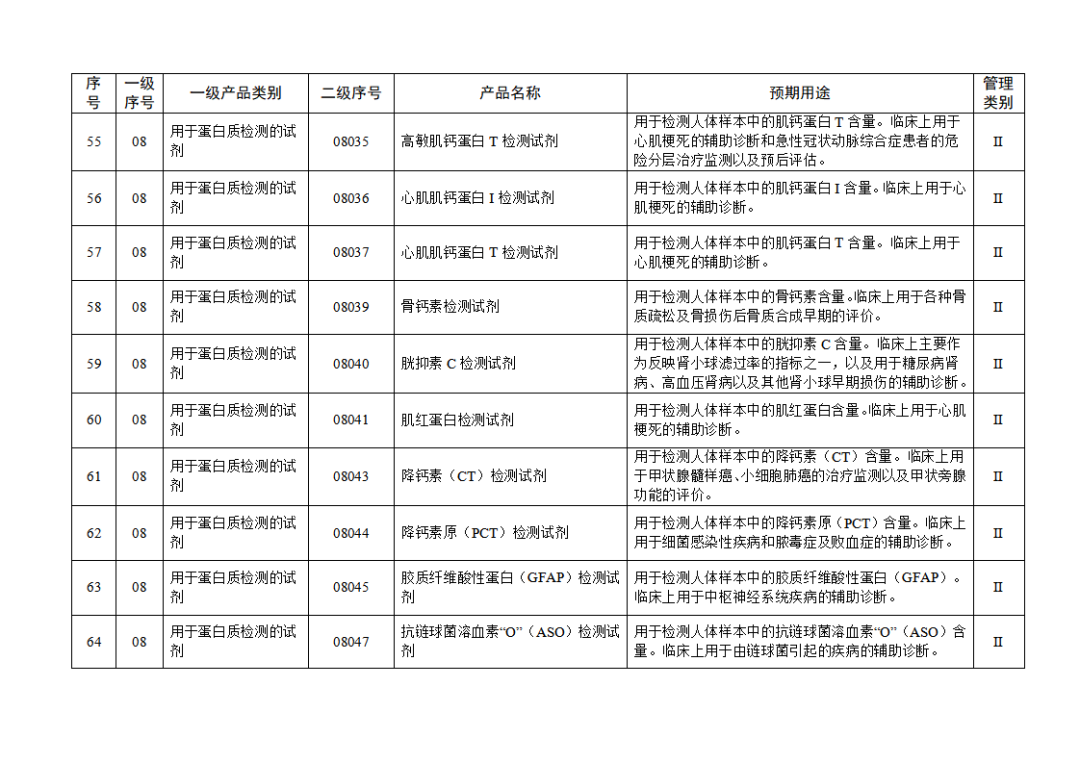
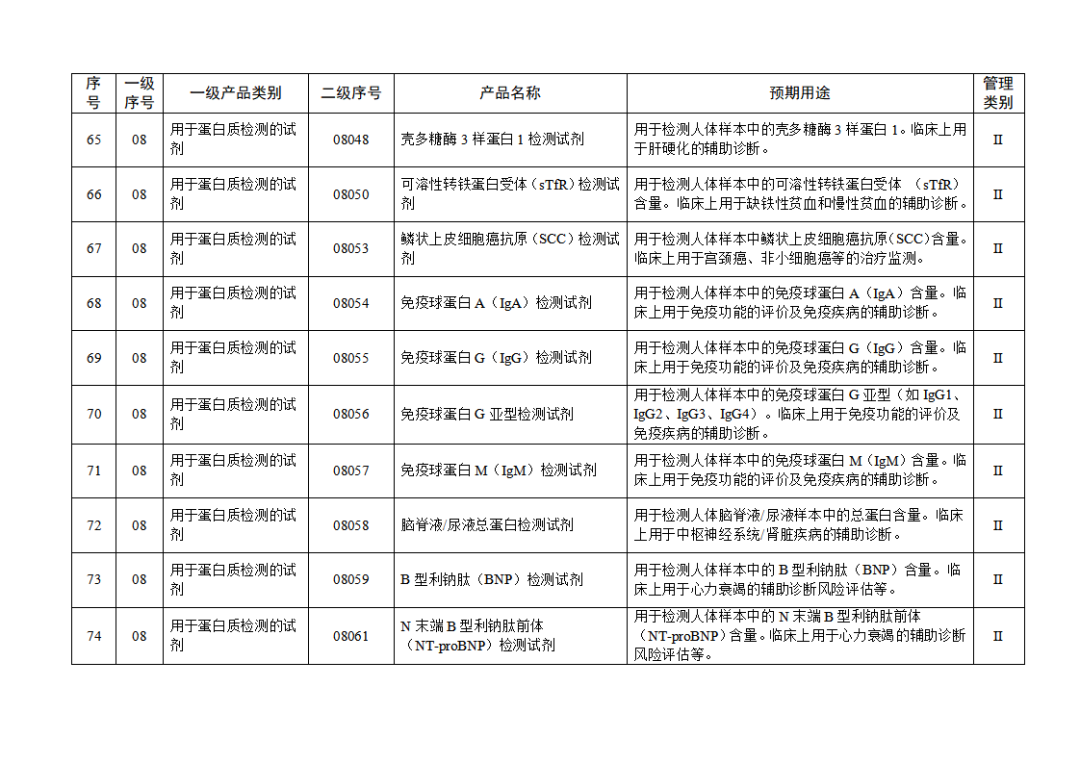
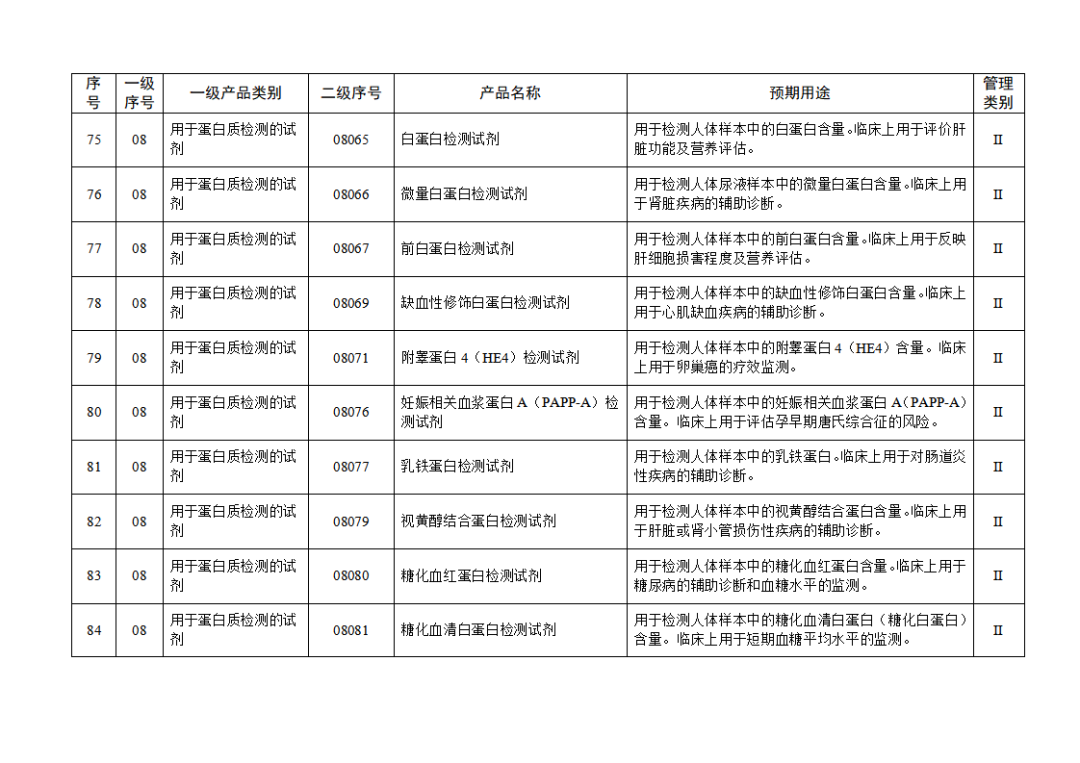
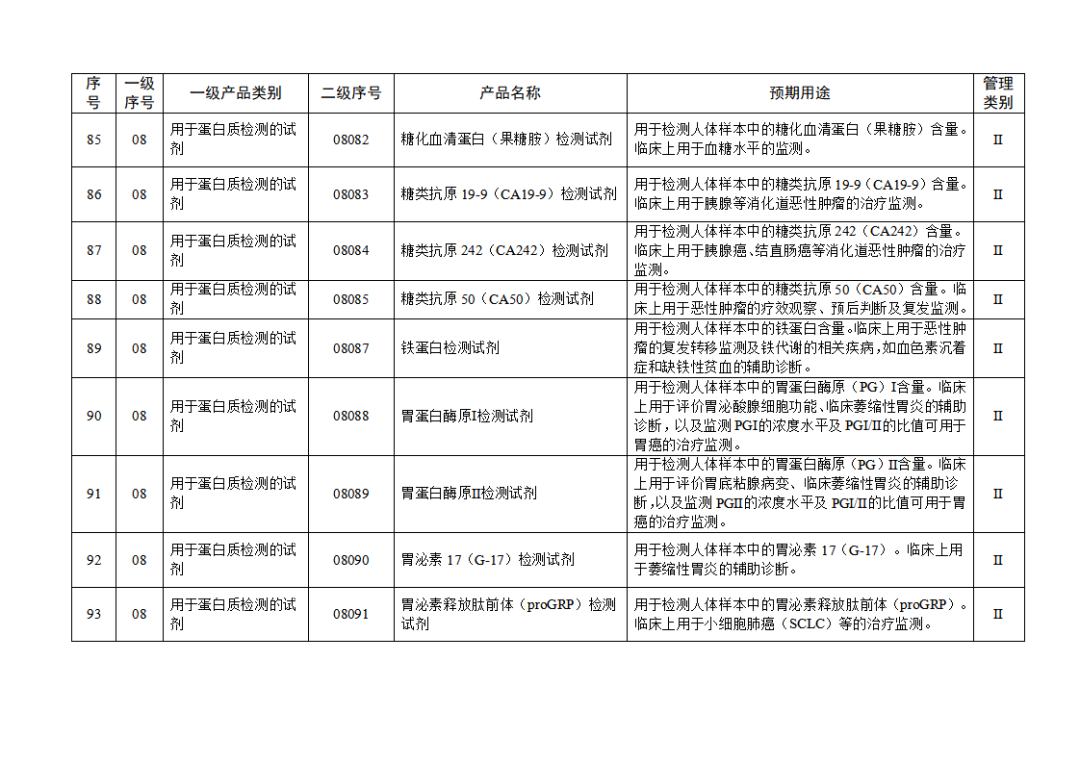
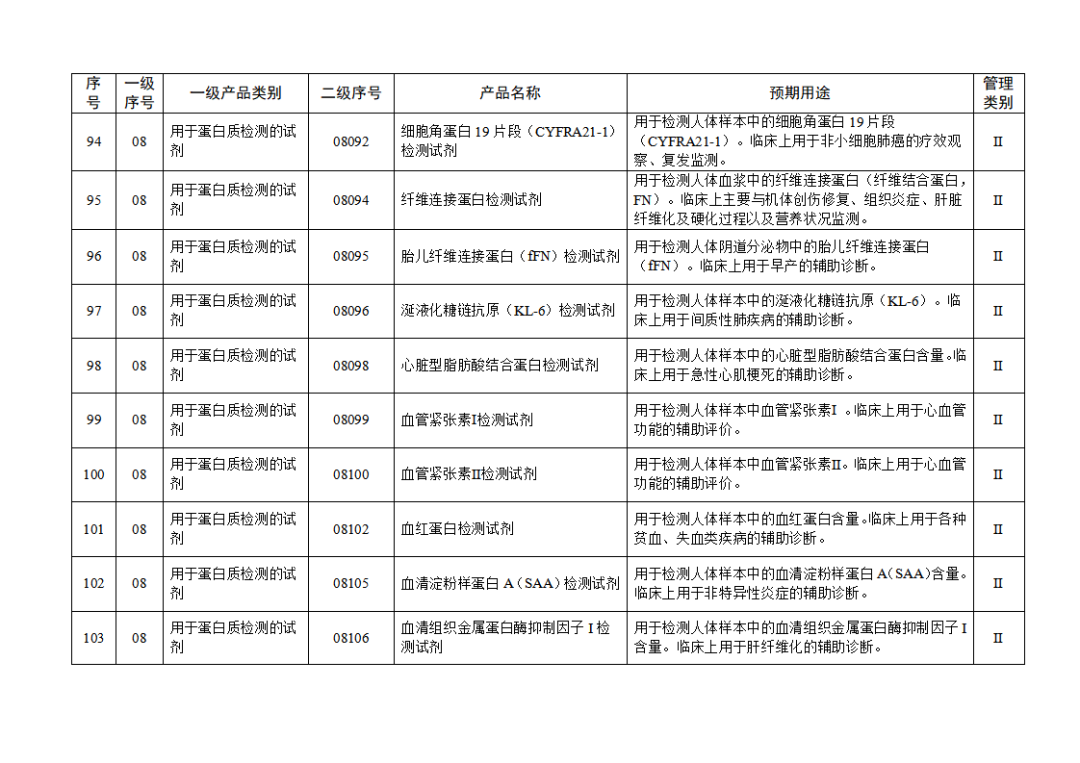
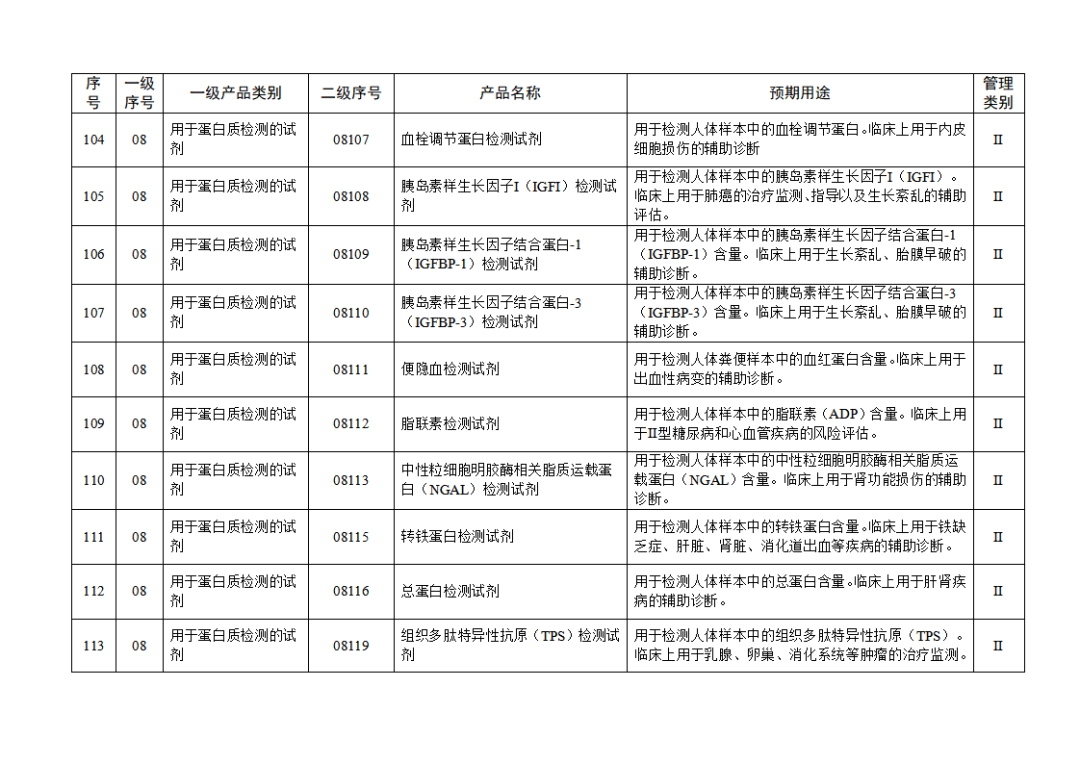
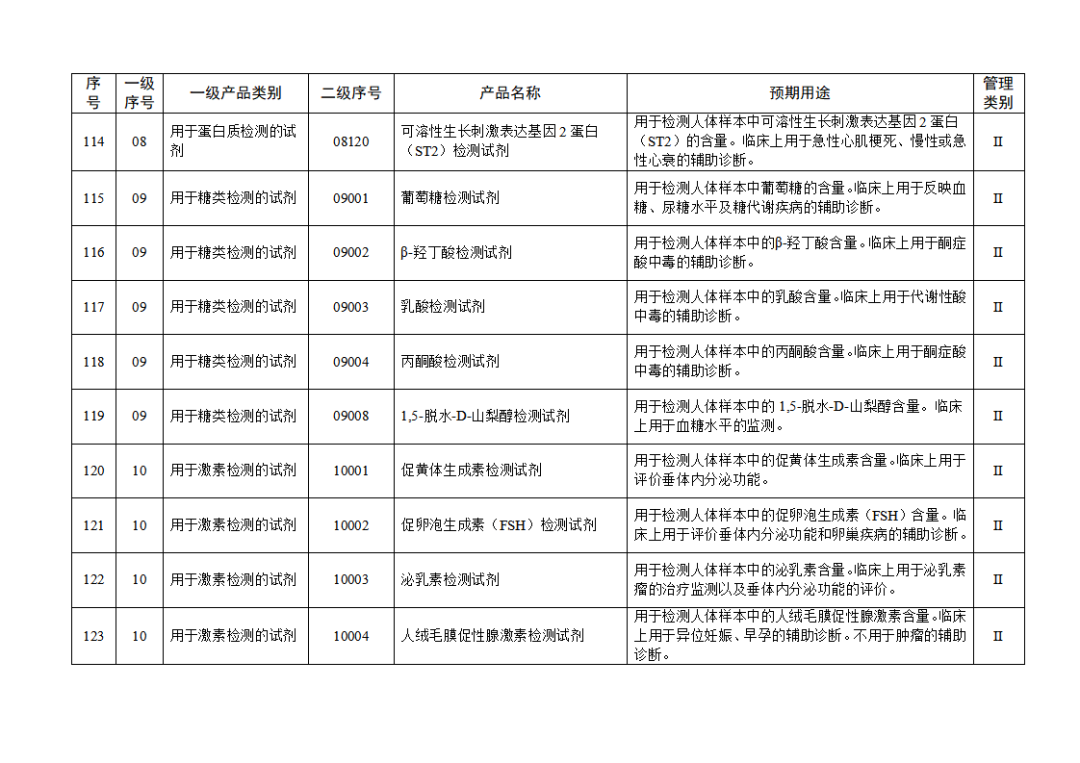
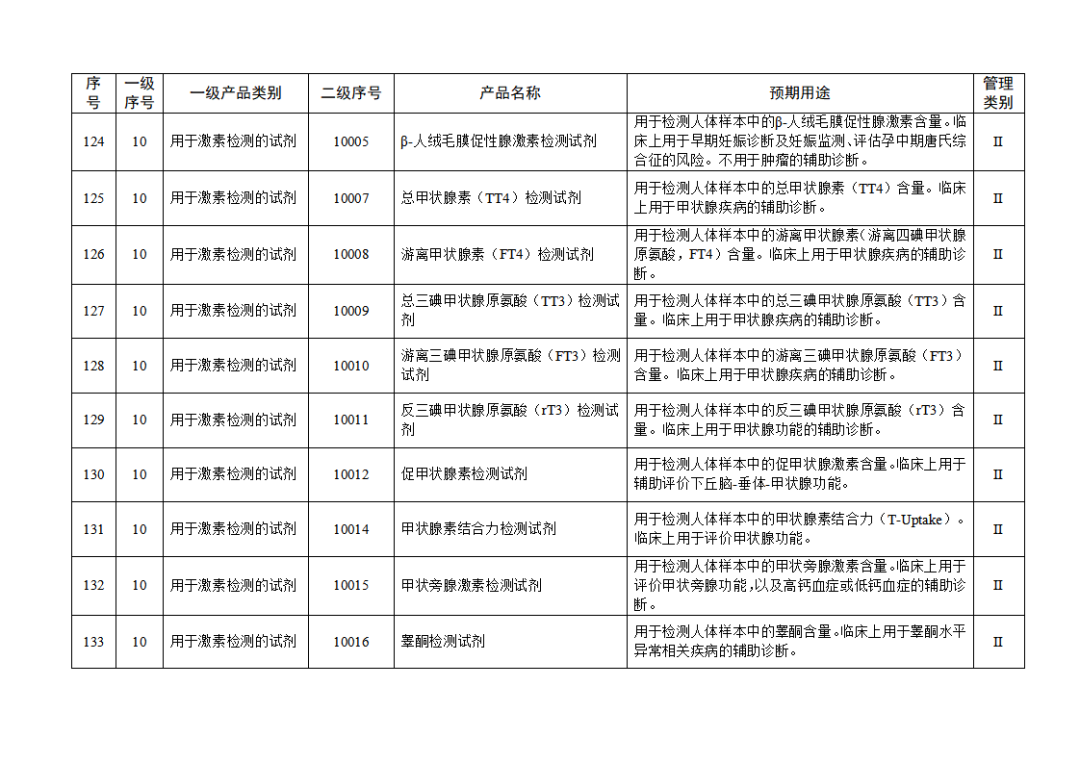
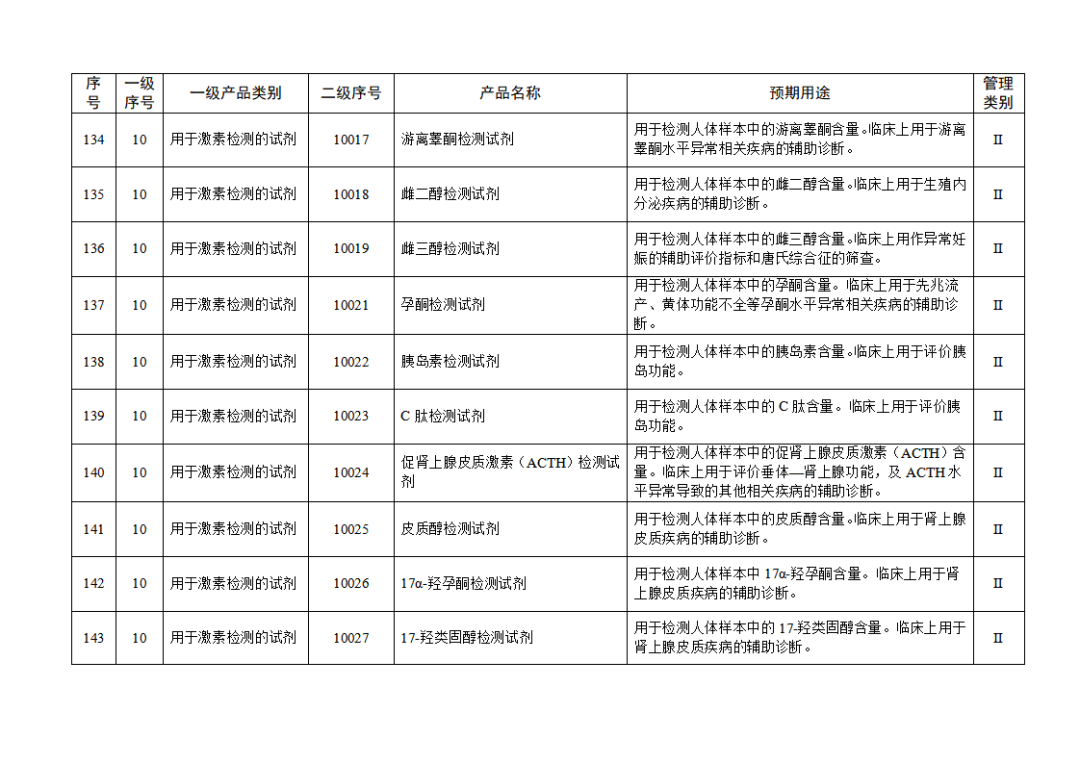
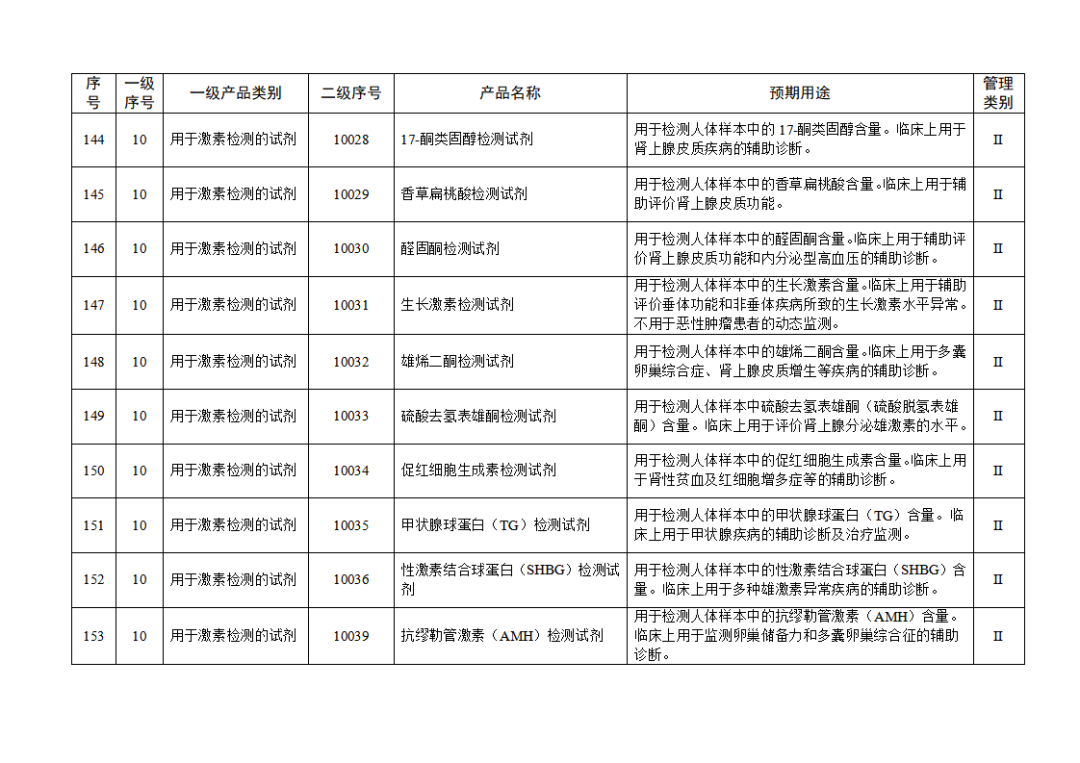
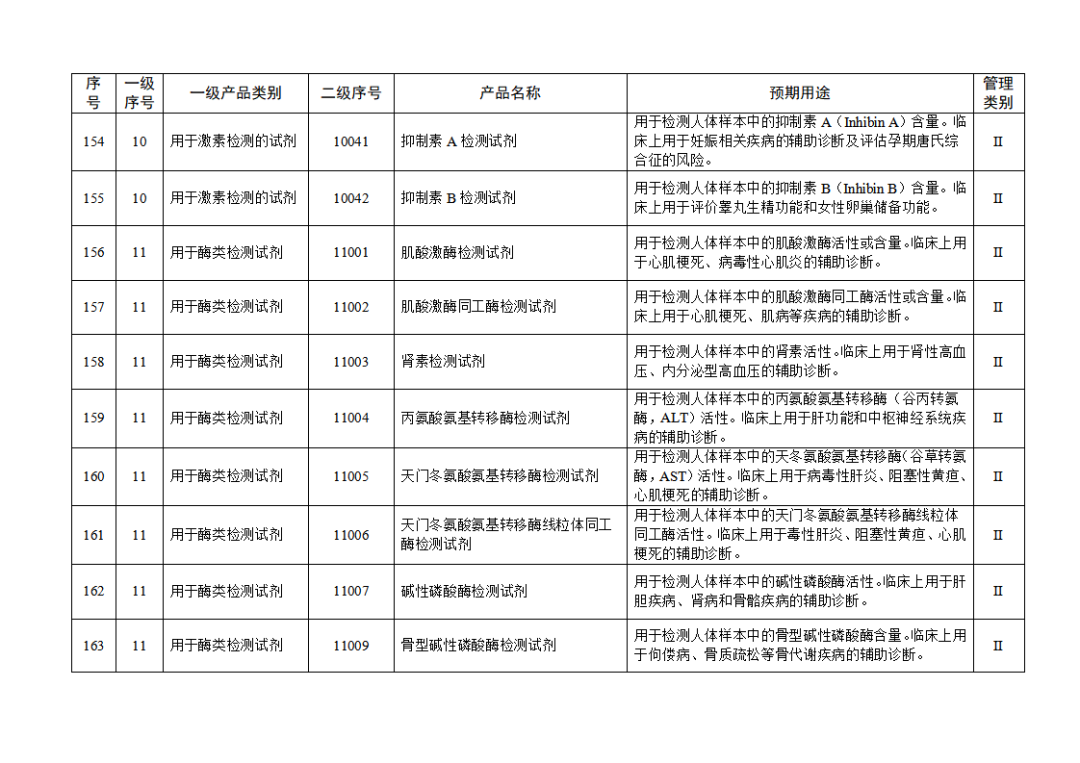
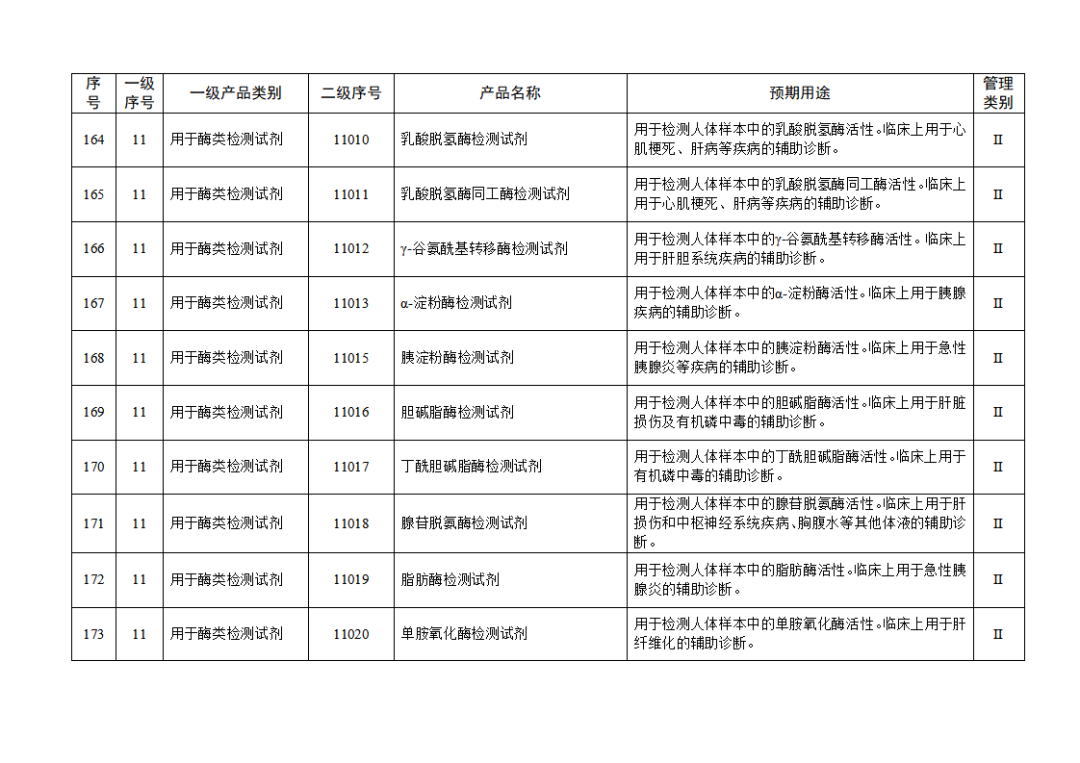
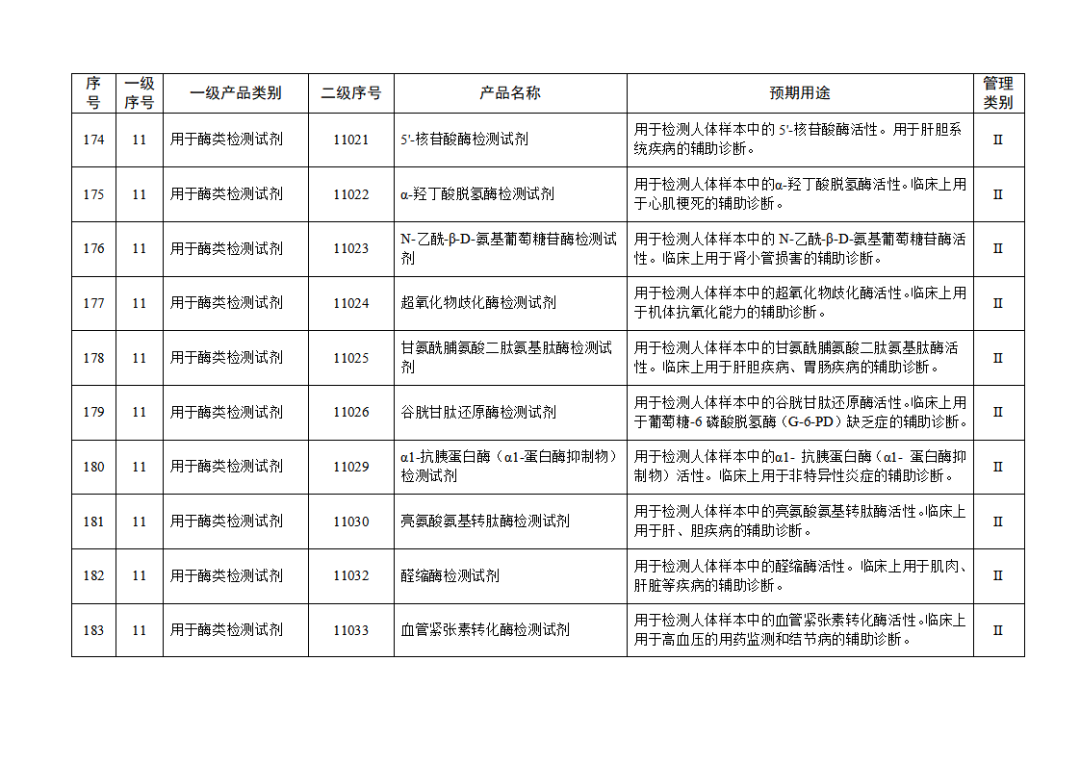
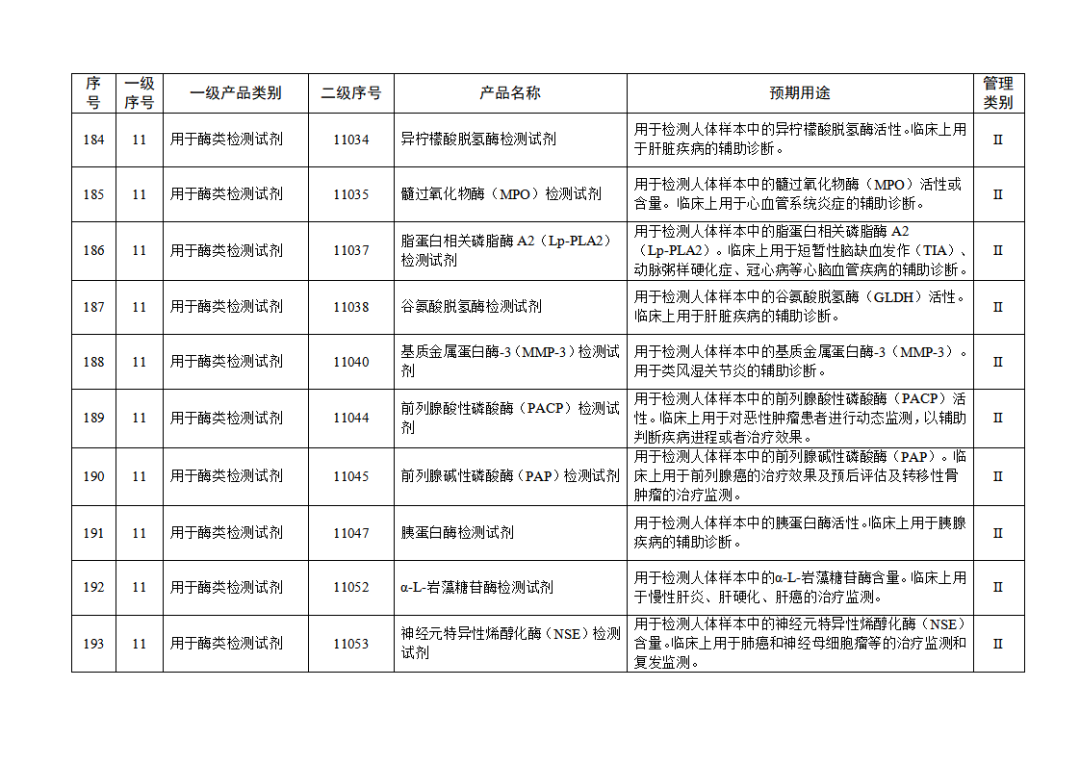
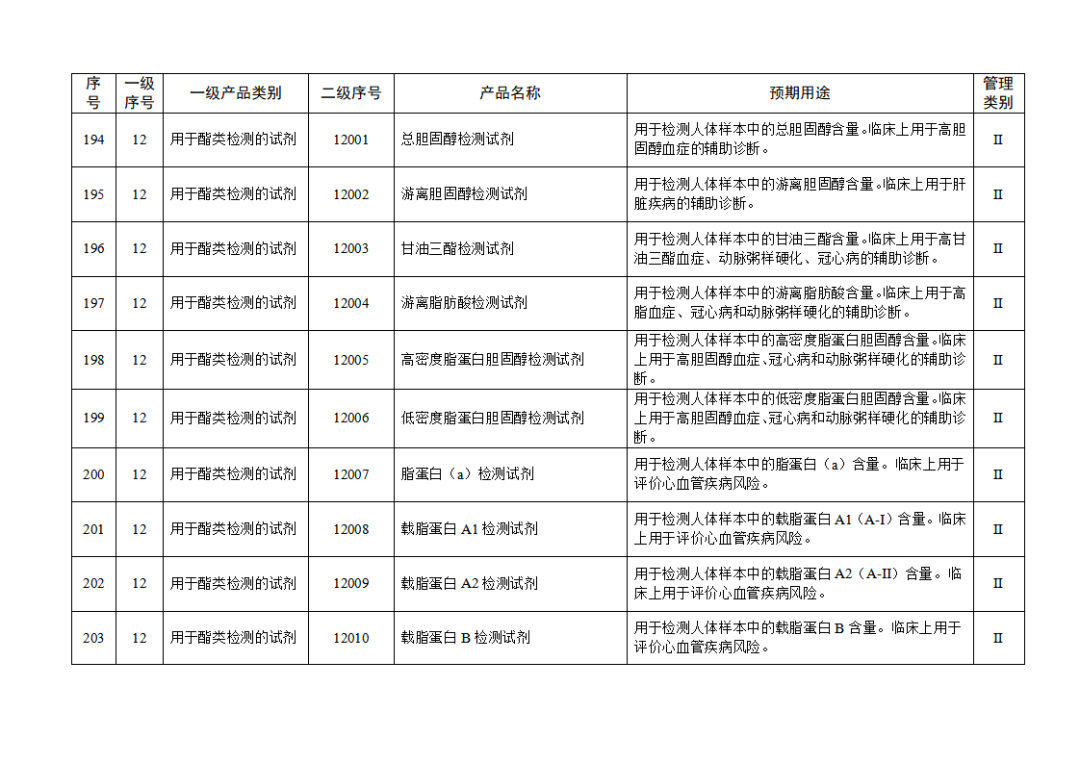
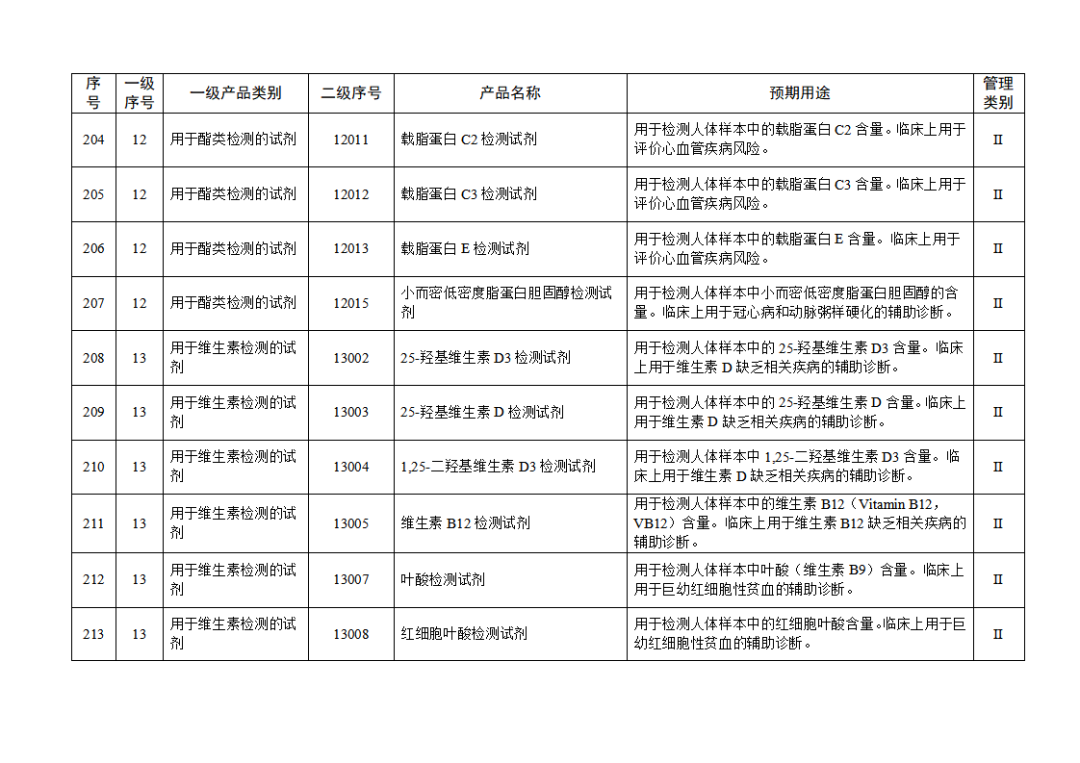
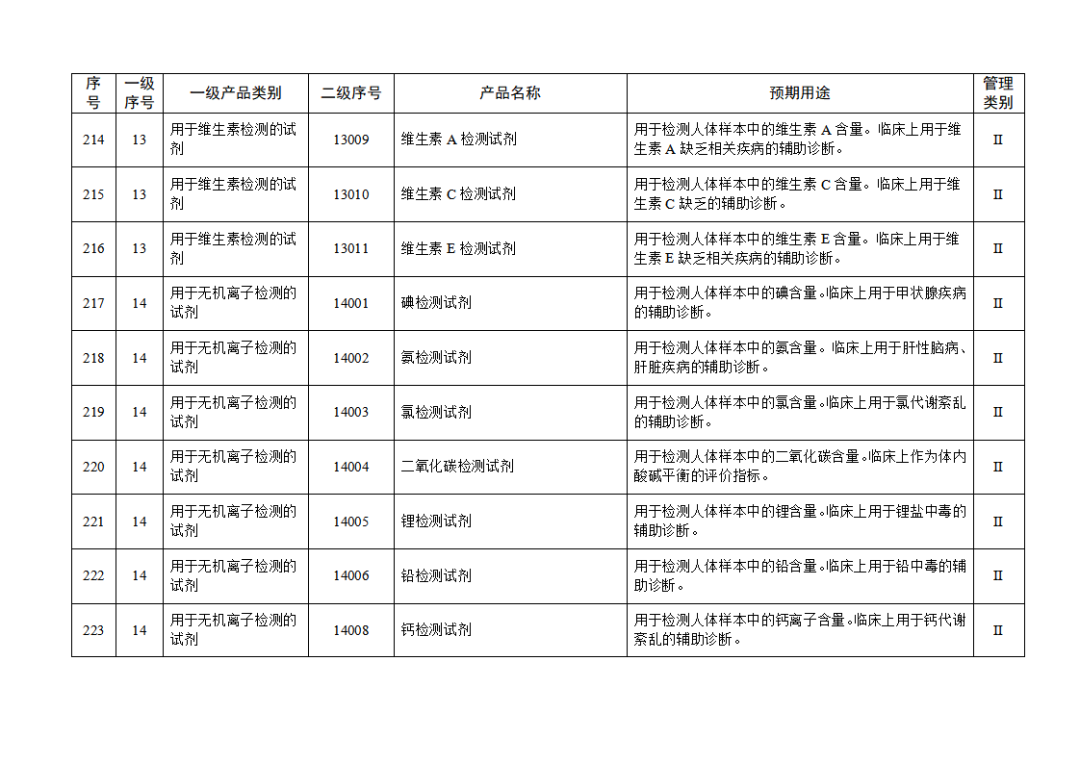
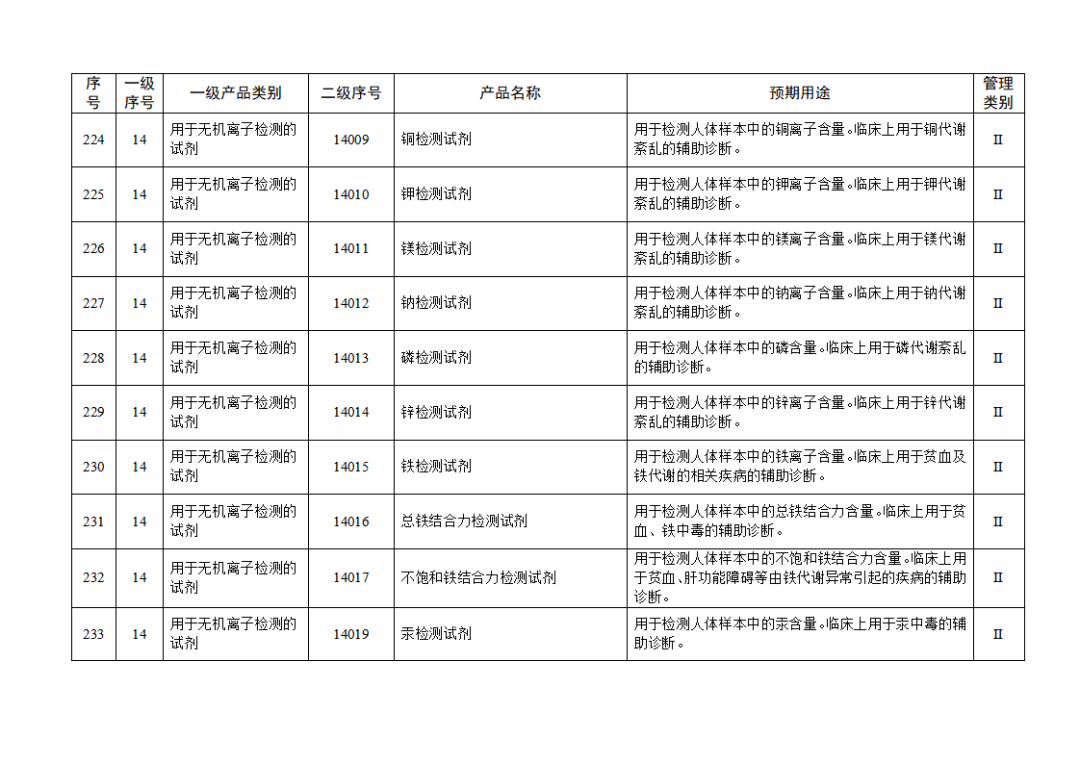
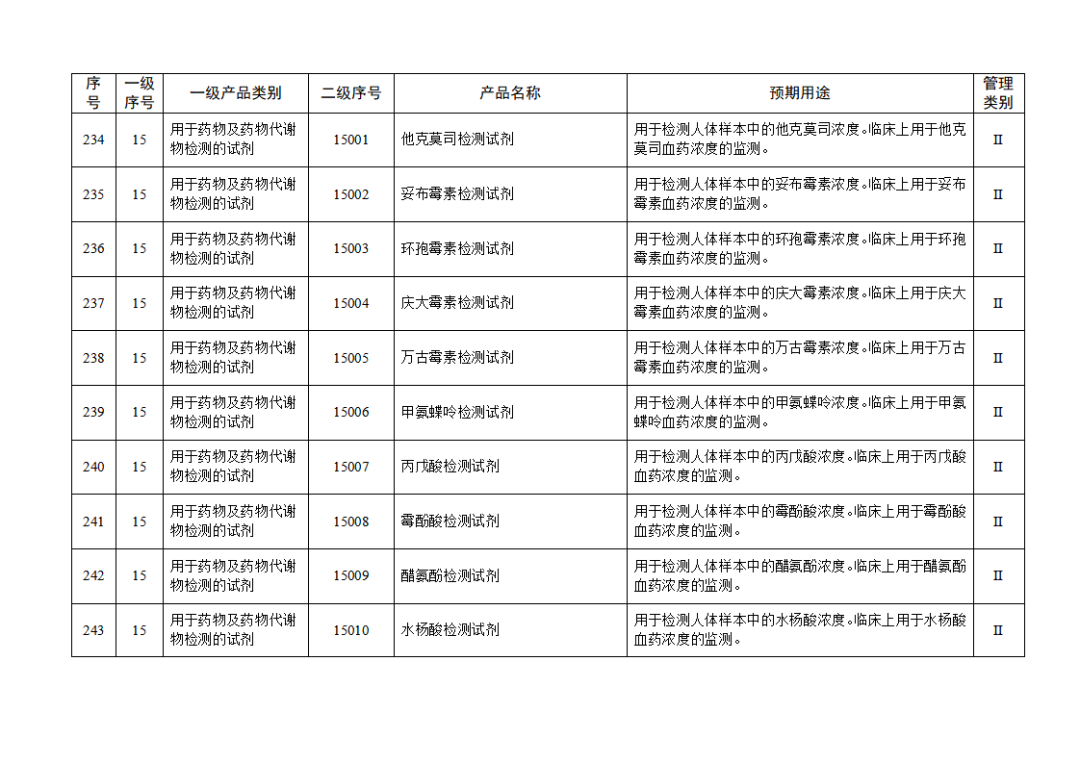
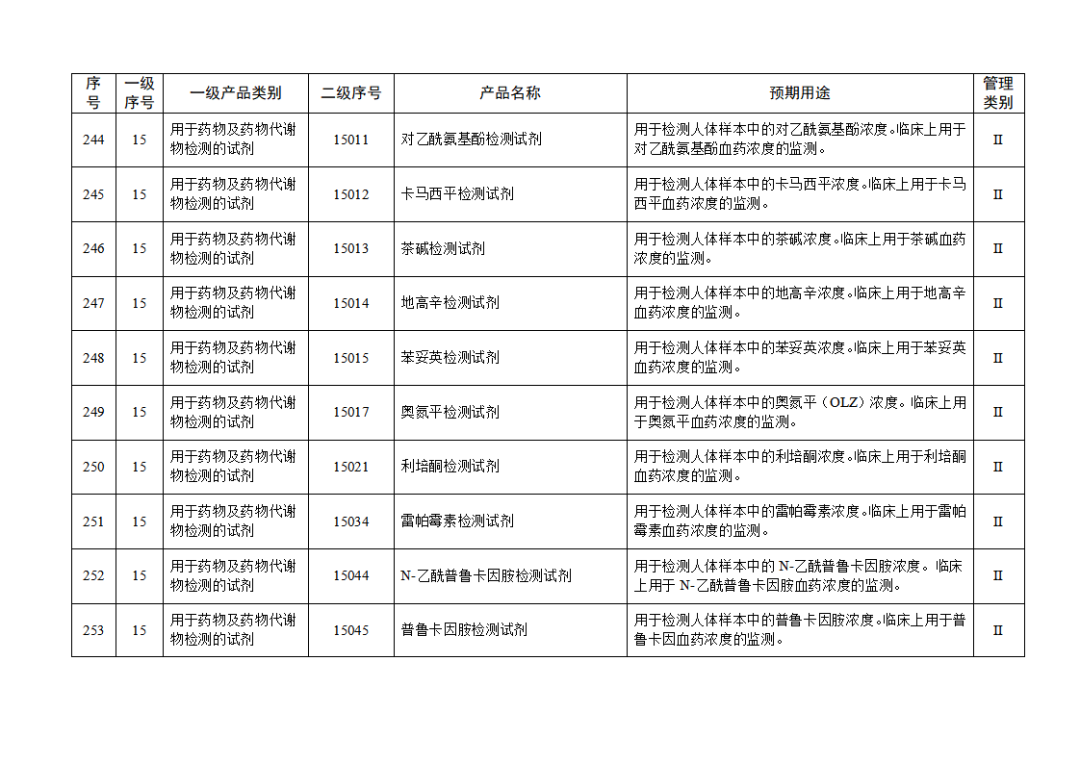
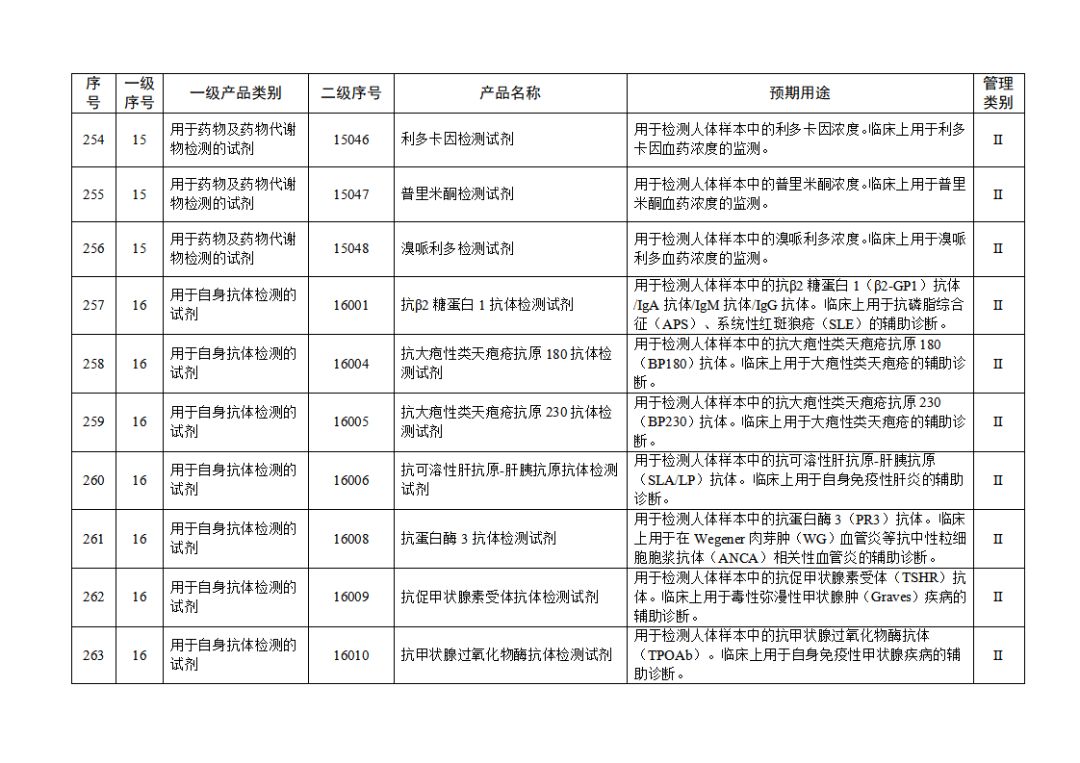
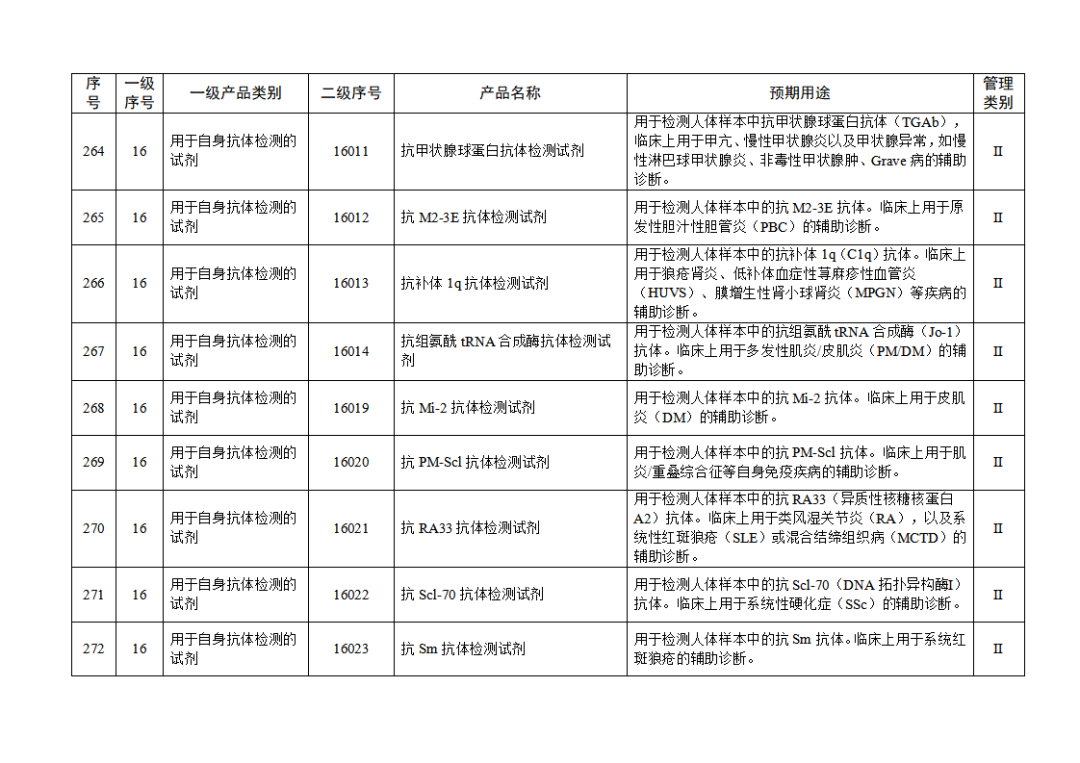
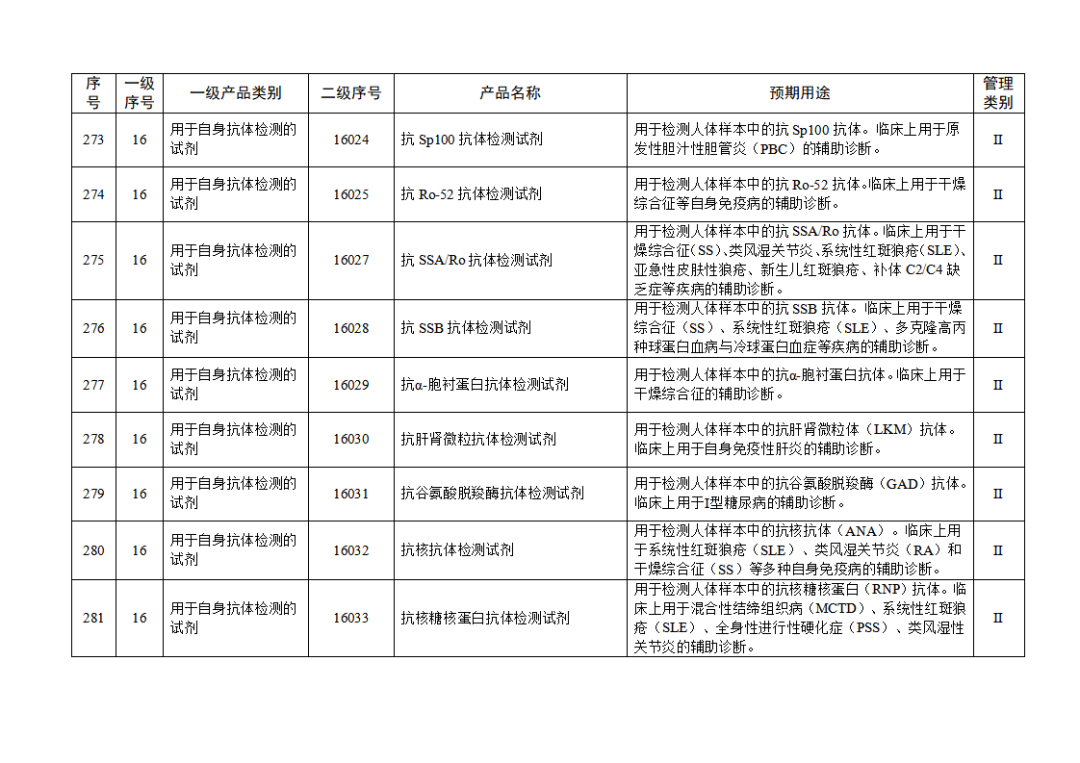
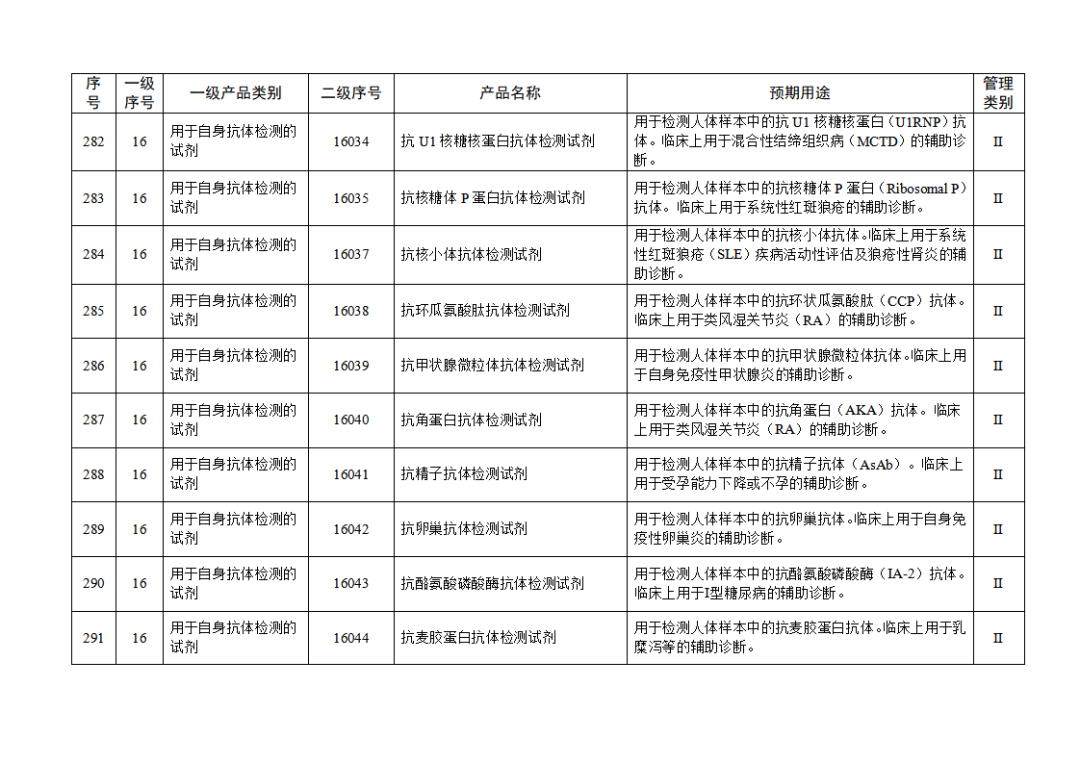
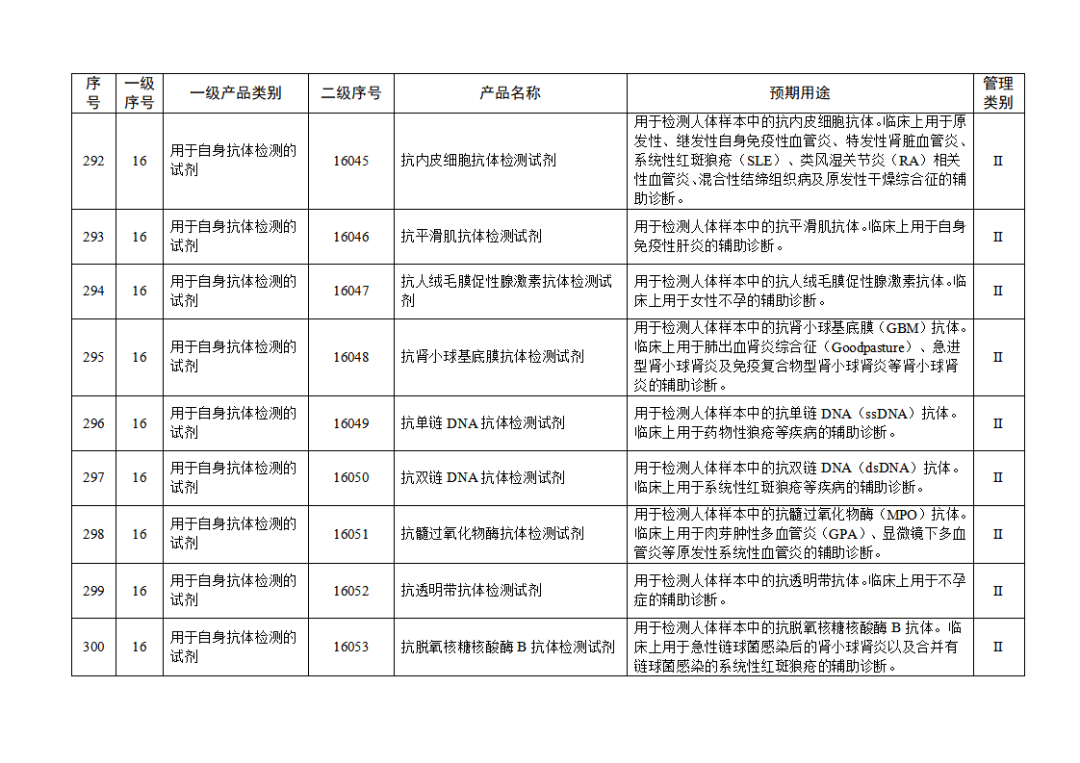
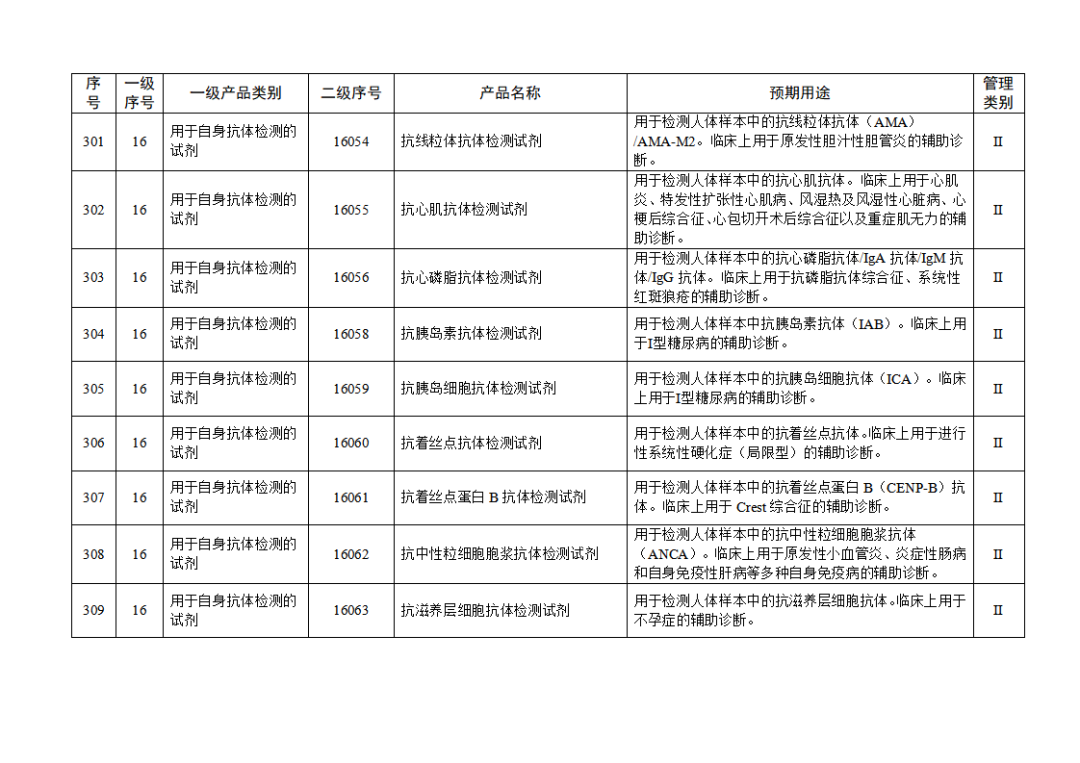
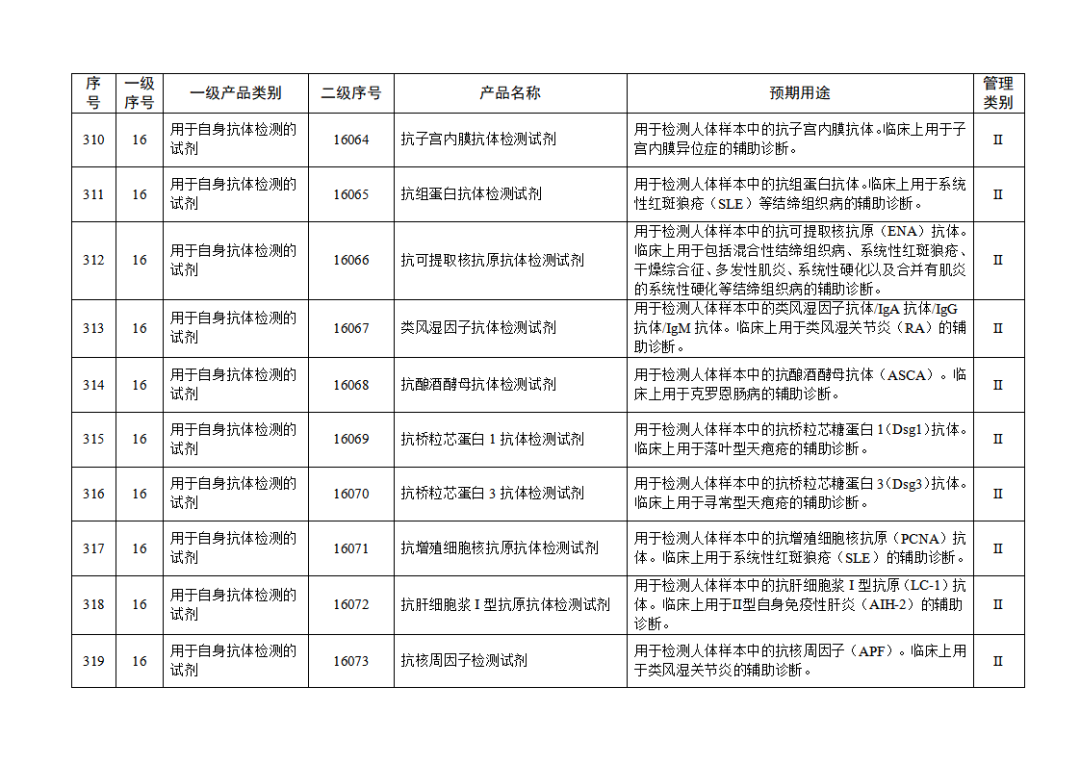
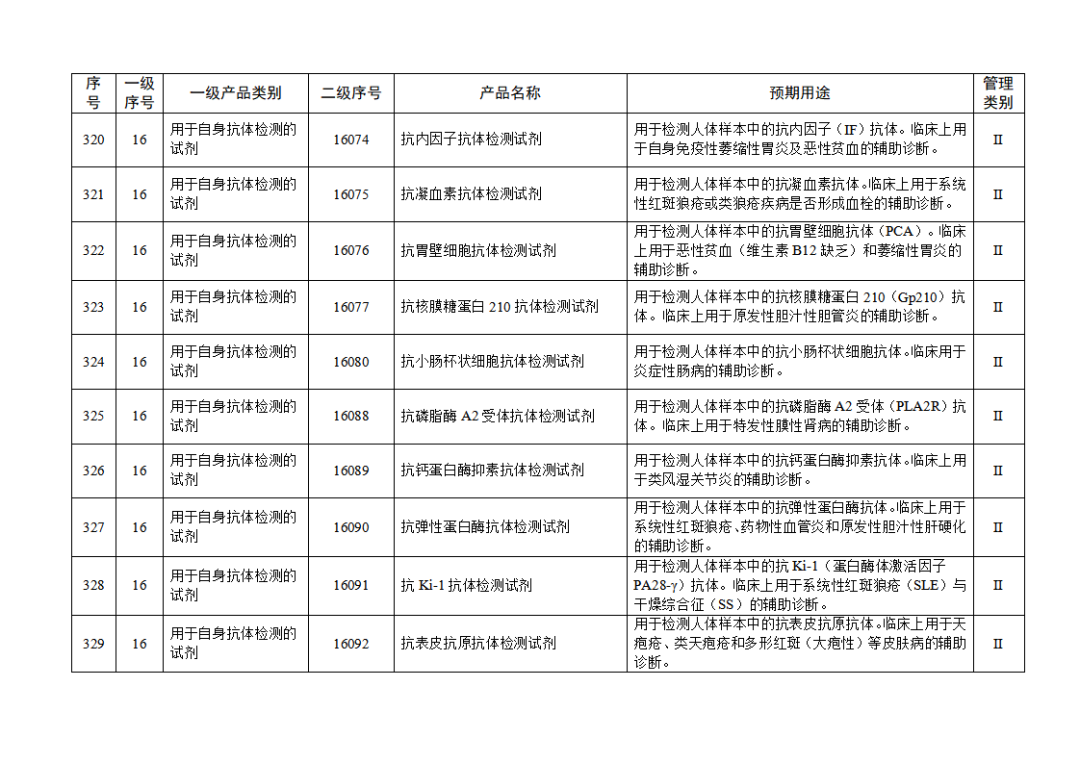
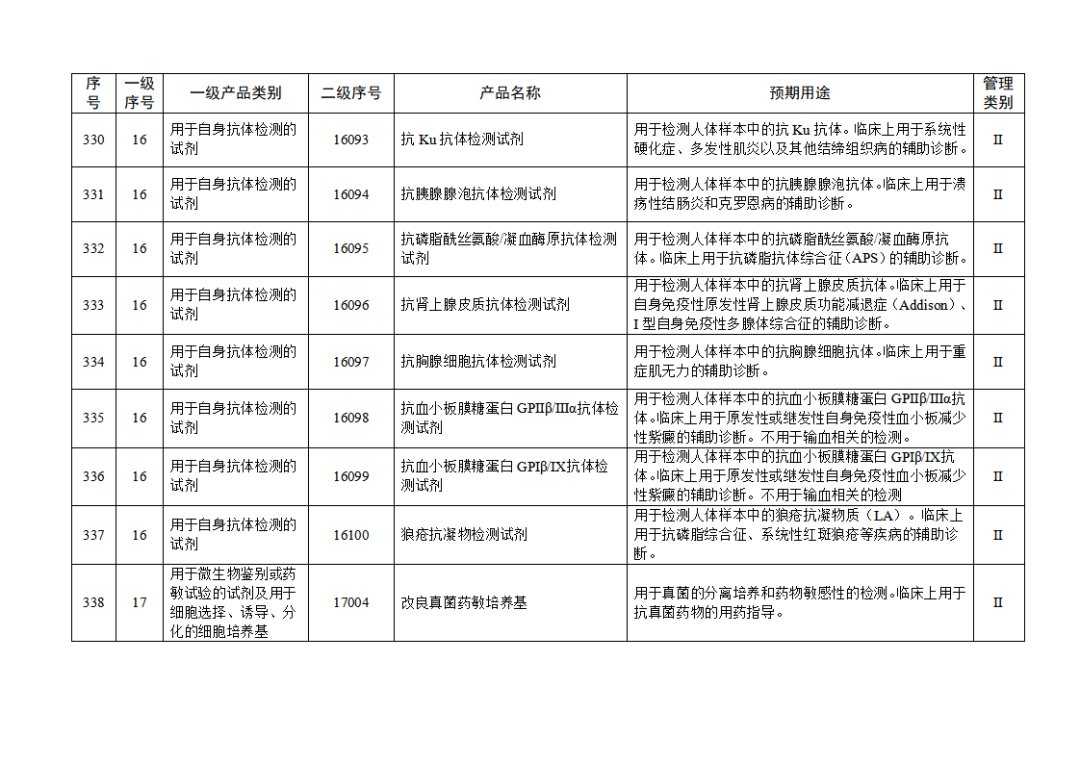
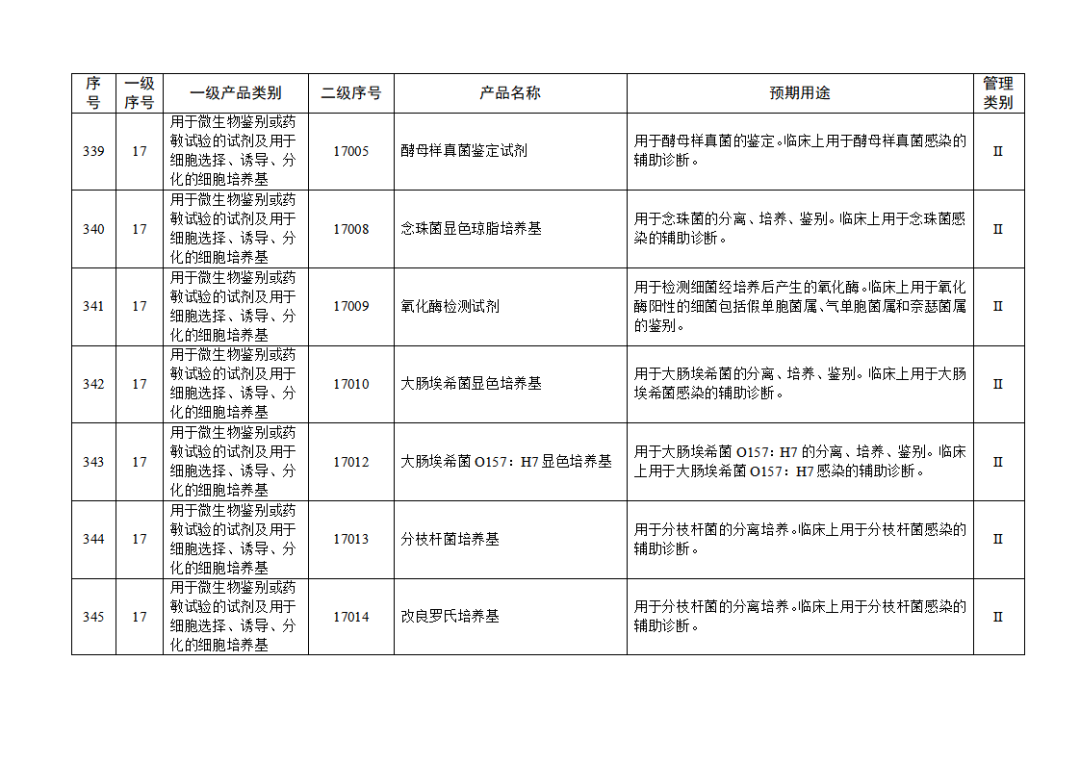
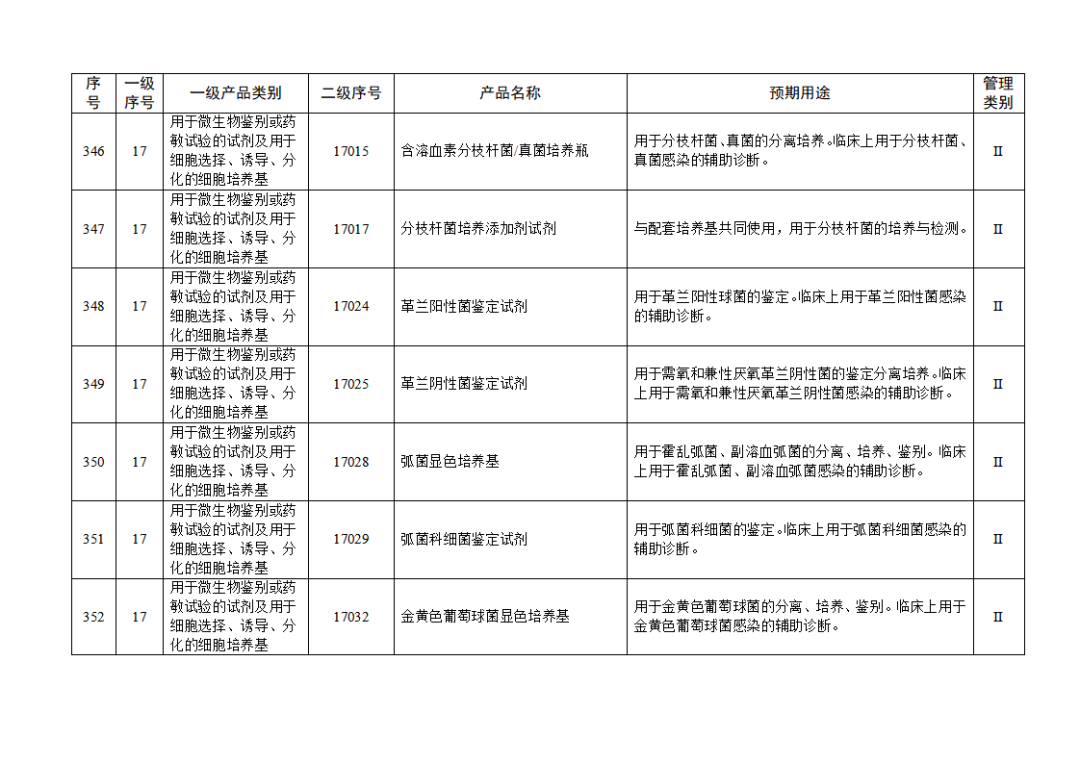
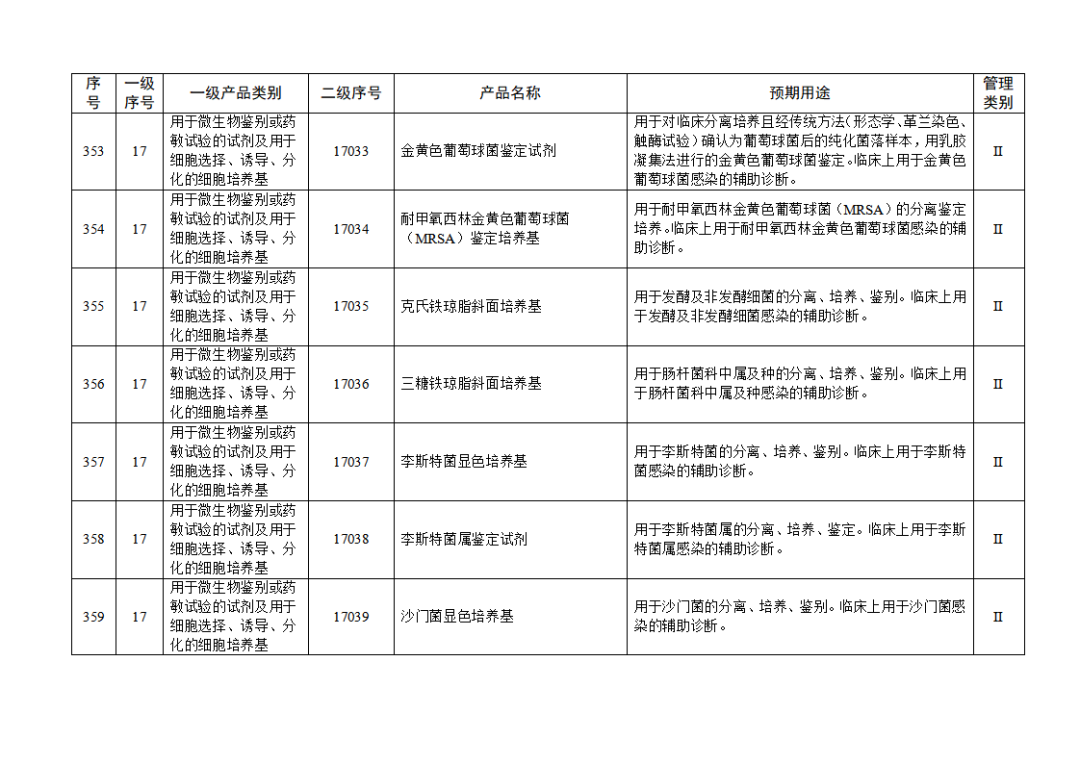
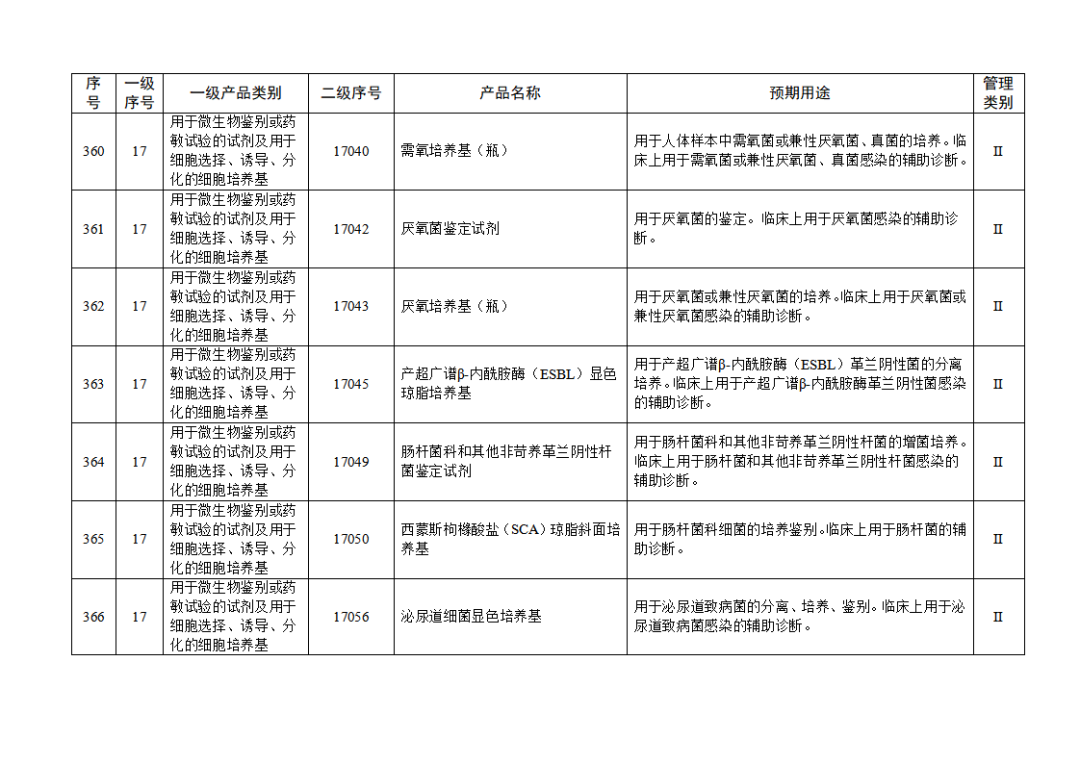
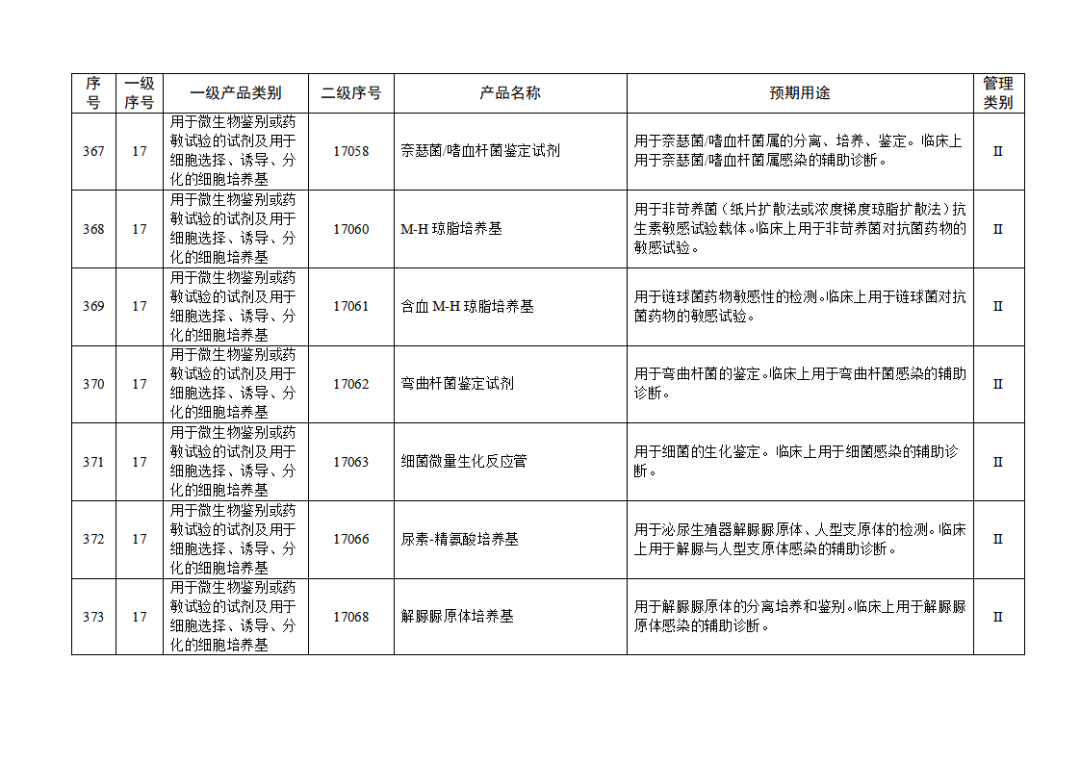
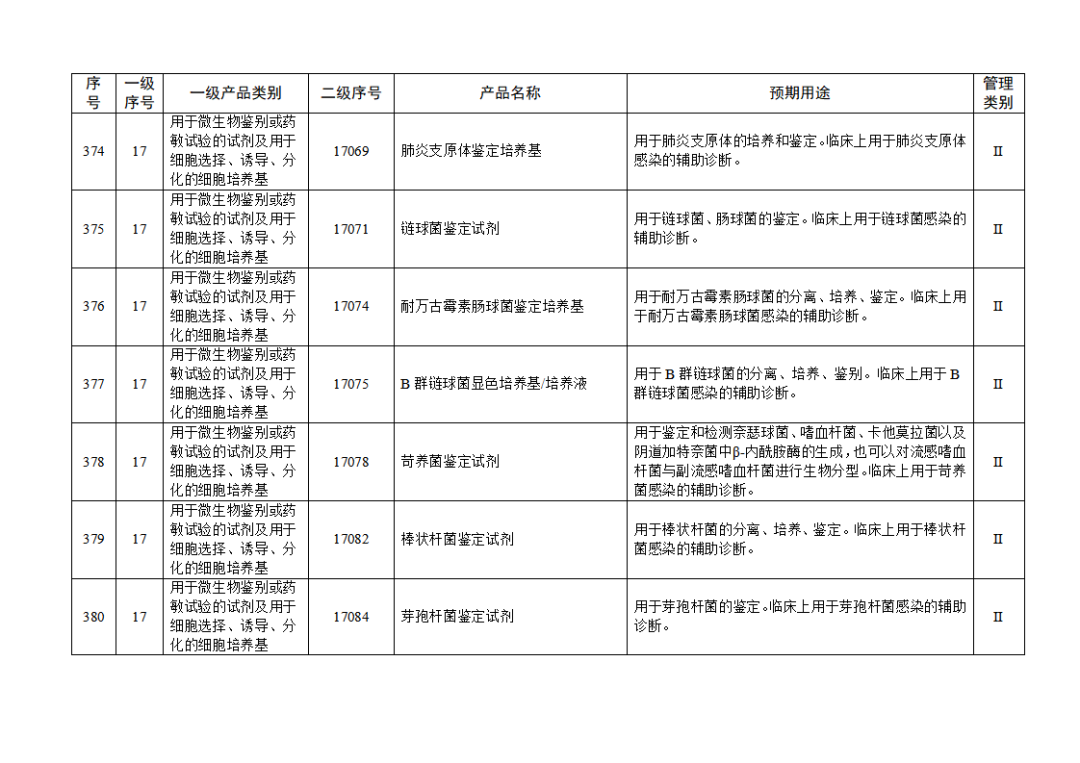
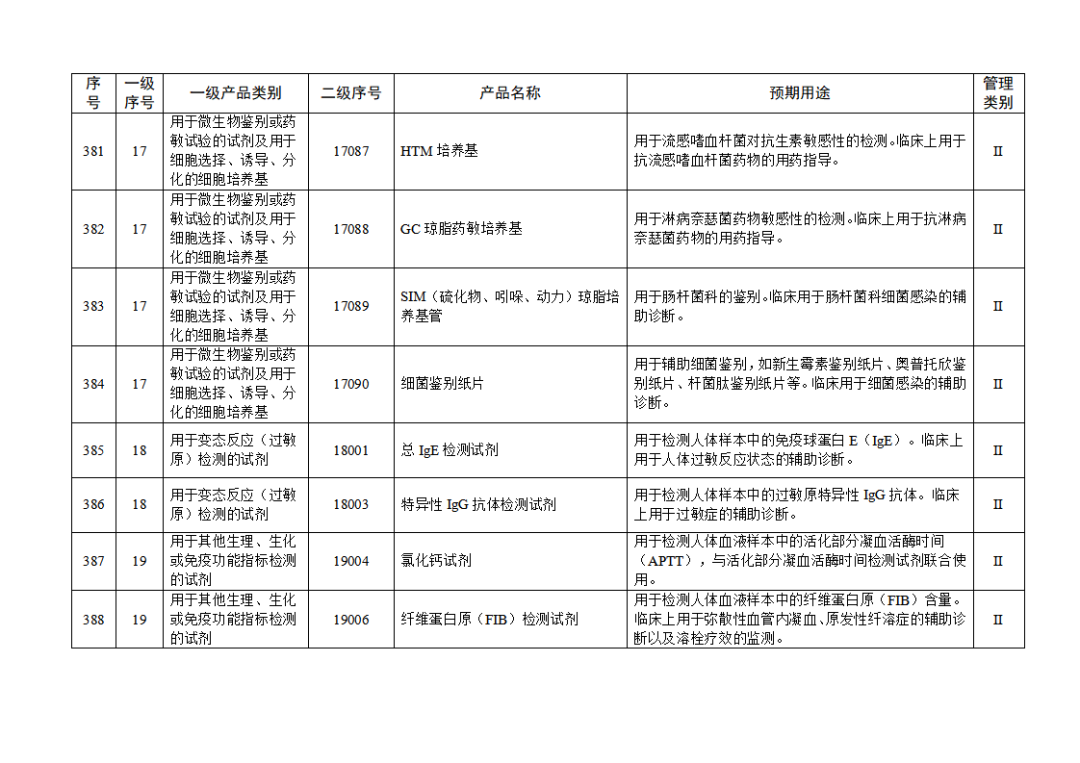
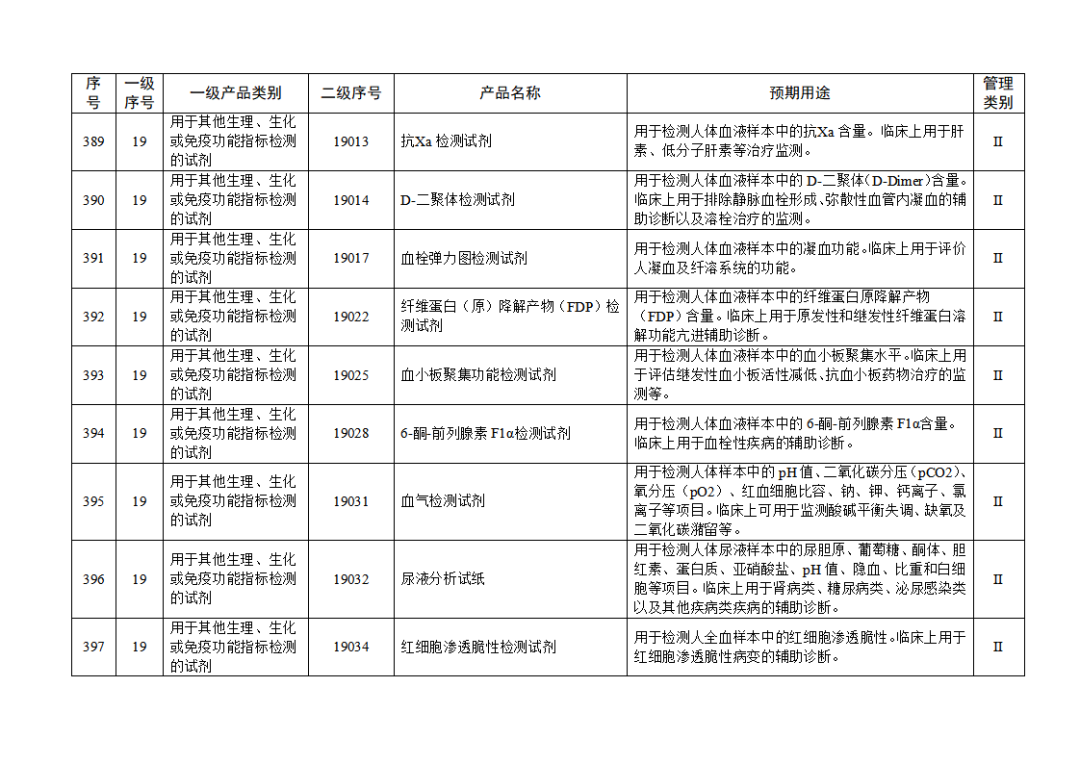
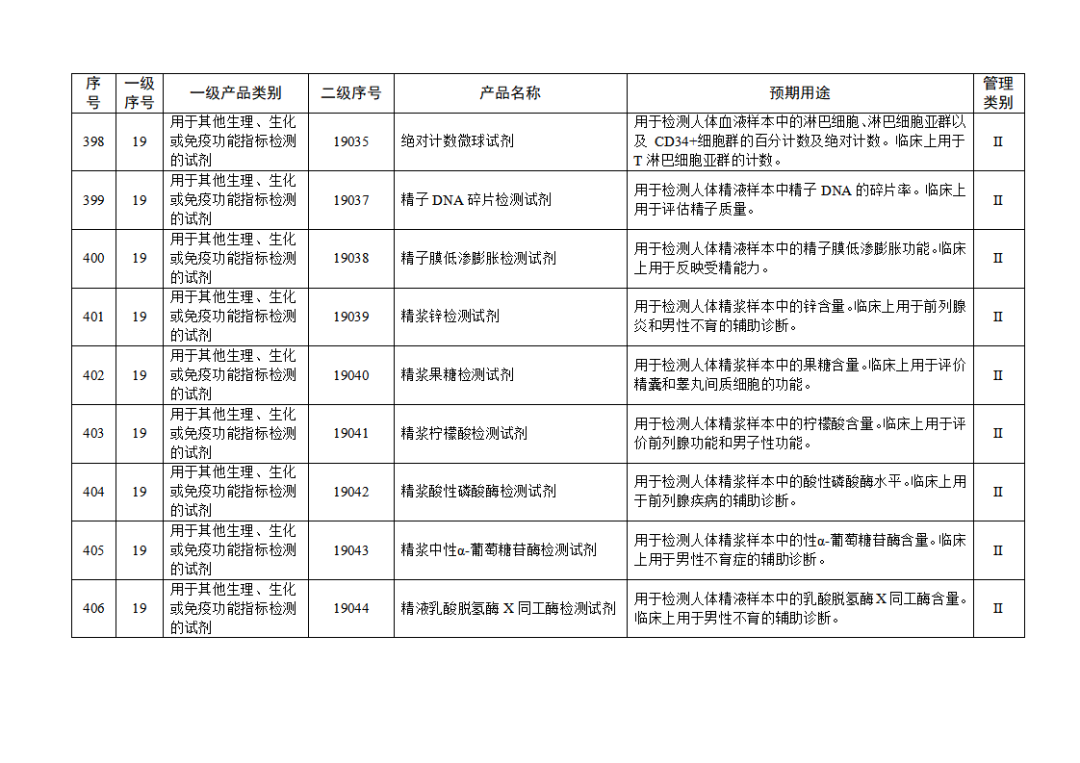
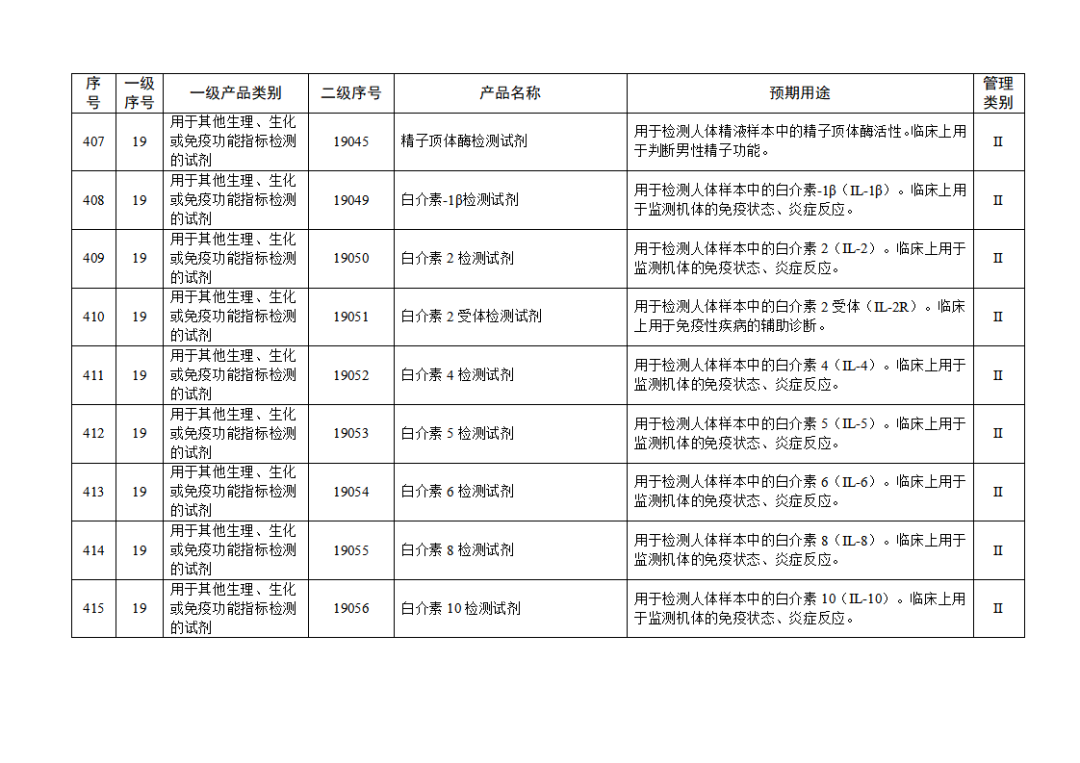
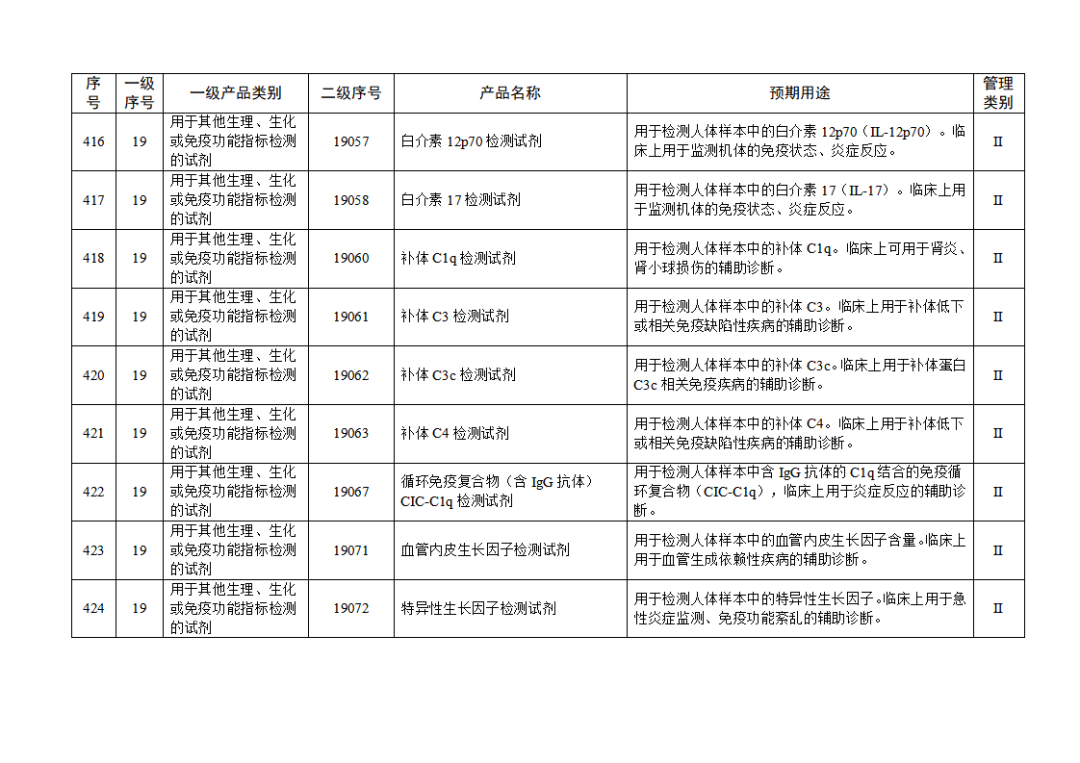
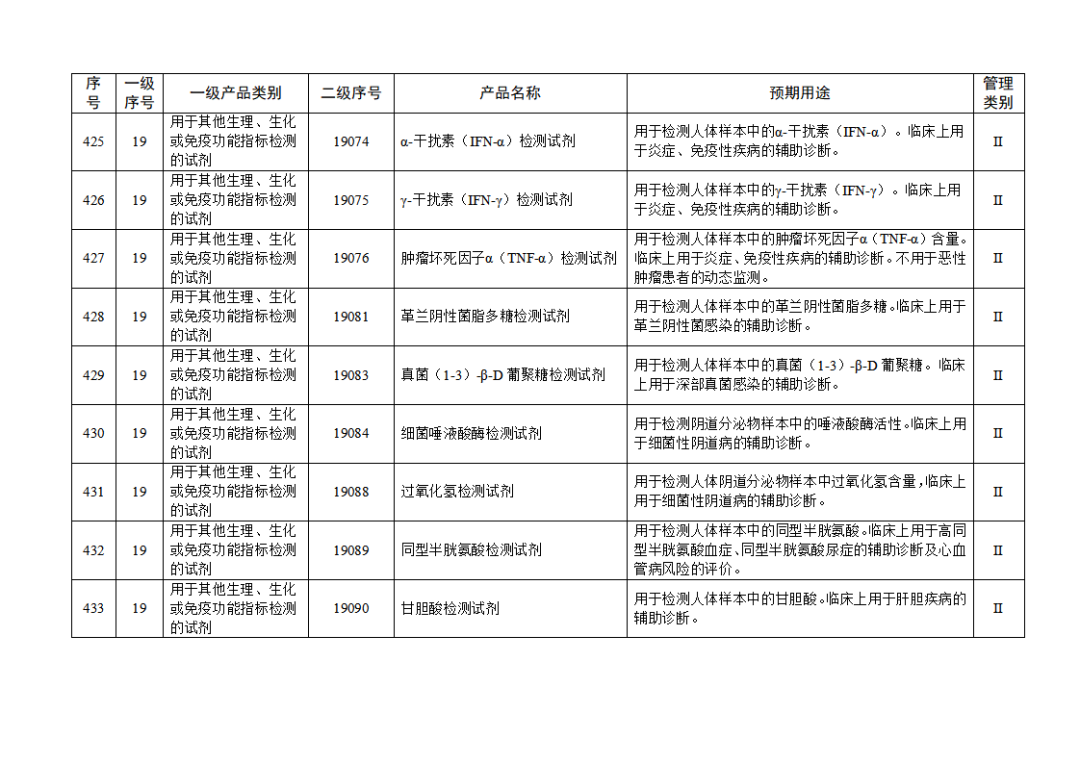
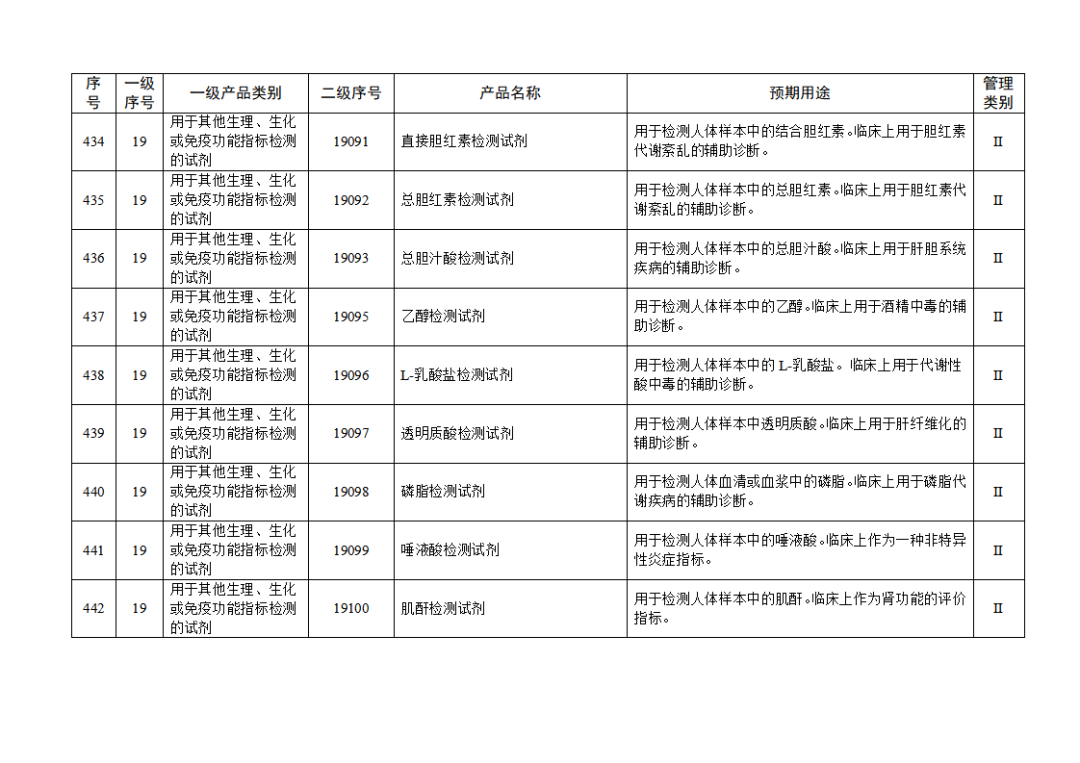
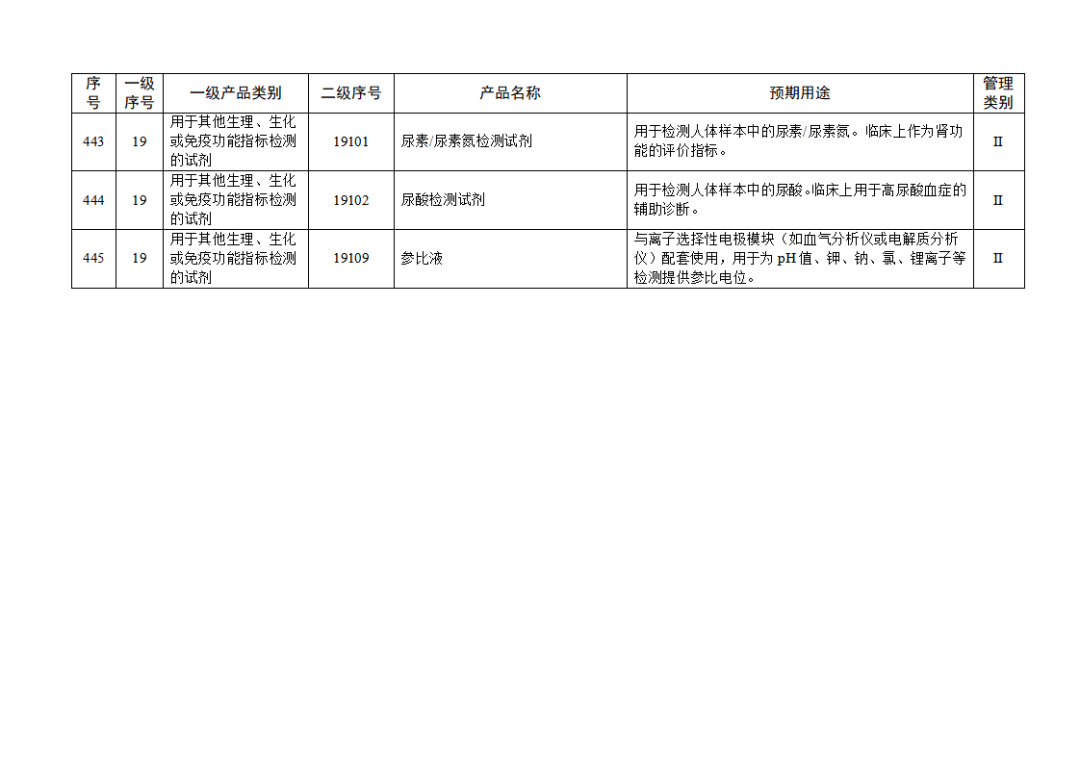
根据《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号),国家药监局组织修订了《免于进行临床试验体外诊断试剂目录》(国家药监局通告2021年第70号),形成《免于进行临床试验体外诊断试剂目录(2025年)》,现予公布,并自公布之日起施行。
特此通告。
附件:免于进行临床试验体外诊断试剂目录(2025年).doc
国家药监局
2025年6月23日

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

《海南博鳌乐城国际医疗旅游先行区临床急需进口药品带离先行区使用管理暂行办法》已经3月24日海南博鳌乐城国际医疗旅游先行区领导小组会议审议通过,现印发给你们,请遵照执行

国家药监局关于发布免于进行临床评价医疗器械目录的通告(2025年第19号)发布时间:2025-05-13为做好医疗器械注册管理工作,根据《医疗器械注册与备案管理

为加强医疗器械生产监督管理,规范医疗器械生产质量管理,根据《医疗器械监督管理条例》(国务院令650号)、《医疗器械生产监督管理办法》(国家食品药品监督管理总局令第7号)

附件:医疗器械监督管理条例(2025年修订版).doc医疗器械监督管理条例(2000年1月4日中华人民共和国国务院令第276号公布 2014年2月12日国务院第

国家药监局器审中心关于发布影像型超声诊断设备(第三类)注册审查指导原则(2023年修订版)的通告(2024年第29号)发布时间:2024-10-14为进一步规范

附件:康复类数字疗法软件产品分类界定指导原则(2025年第27号).doc康复类数字疗法软件产品分类界定指导原则一、目的为指导康复类数字疗法软件产品管理属性和管

国家药监局药审中心关于发布《抗肿瘤药物临床试验中SUSAR分析与处理技术指导原则》的通告(2024年第42号) 发布日期:20241010

为深化药品审评审批制度改革,鼓励创新,进一步推动我国药物临床试验规范研究和提升质量,国家药品监督管理局会同国家卫生健康委员会组织修订了《药物临床试验质量管理规范》

为深化医疗器械审评审批制度改革,加强医疗器械临床试验管理,根据《医疗器械监督管理条例》(国务院令第739号)及《医疗器械注册与备案管理办法》(市场监管总局令第47号)、《

国家药监局关于发布免于临床试验的体外诊断试剂临床评价技术指导原则的通告(2021年第74号)发布时间:2021-09-24为指导体外诊断试剂的临床评价工作,根据
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台