山东省医疗器械工艺用水现场检查指南(鲁药监械〔2021〕35号)
为规范医疗器械现场检查,提升检查员现场检查能力,指导检查员对医疗器械生产企业工艺用水控制情况的检查,提高企业工艺用水质量安全保证水平,依据《医疗器械监督管理条例》
来源:医疗器械注册代办 发布日期:2021-04-15 阅读量:次

发布时间:2021-04-15
为进一步加强重组胶原蛋白类医疗产品监督管理,推动产业高质量发展,国家药监局组织制定了《重组胶原蛋白类医疗产品分类界定原则》,现予公布。
特此通告。
国家药监局
2021年4月13日
附件
为规范重组胶原蛋白类医疗产品管理属性和管理类别判定,根据《医疗器械监督管理条例》《医疗器械分类规则》《医疗器械分类目录》《关于药械组合产品注册有关事宜的通告》等制定本原则。
本原则规定的重组胶原蛋白类医疗产品是指以重组胶原蛋白为主要成分,以医疗为目的的产品。
重组胶原蛋白类医疗产品的管理属性应当依据产品预期用途、作用机制等进行综合判定。
(一)不符合《医疗器械监督管理条例》有关医疗器械定义的重组胶原蛋白类产品,不作为医疗器械管理。例如(但不限于)用于改善阴道干涩状态的重组胶原蛋白类产品。
(二)产品实现医疗器械用途,同时含有发挥药理学作用的药物成分时,应当根据产品主要作用机制判定以药品作用为主或者以医疗器械作用为主的药械组合产品。以药品作用为主的药械组合产品,按照药品申报注册;以医疗器械作用为主的药械组合产品,按医疗器械申报注册。
(三)产品符合医疗器械定义且不含有发挥药理学作用的药物成分时,作为医疗器械管理。
对于属性判定作为医疗器械管理的重组胶原蛋白类医疗产品,应当依据产品的材料特性、结构特征、预期用途、使用形式等综合判定产品管理类别。
(一)重组胶原蛋白类产品的管理类别应当不低于第二类。
(二)重组胶原蛋白类产品作为无源植入物应用时,应当按照第三类医疗器械管理。
(三)重组胶原蛋白类产品作为止血和防黏连材料应用时,若产品可部分或全部被人体吸收或者用于体内时,按照第三类医疗器械管理;若产品不可被人体吸收且仅用于体表时,按照第二类医疗器械管理。
(四)重组胶原蛋白类产品作为医用敷料应用时,若产品可部分或者全部被人体吸收,或者用于慢性创面,按照第三类医疗器械管理;若产品不可被人体吸收且用于非慢性创面,按照第二类医疗器械管理。
重组胶原蛋白类产品的分类编码应当根据产品的预期用途,参照《医疗器械分类目录》予以确定。
(一)自本通告发布之日起,重组胶原蛋白类医疗产品应当按照上述原则申请注册。已按照医疗器械受理注册申请的产品,继续按照原受理类别进行审评审批。
(二)已获准按照医疗器械注册的重组胶原蛋白类产品,其注册证在有效期内继续有效。在注册证有效期内提出注册申请的,如在开展产品类别转换期间注册证到期的,注册人可向原审批部门提出原注册证的延期申请。予以延期的,原注册证有效期原则上不得超过2023年12月31日。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
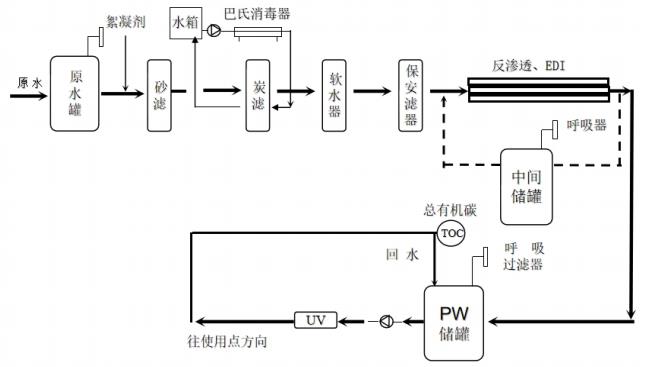
为规范医疗器械现场检查,提升检查员现场检查能力,指导检查员对医疗器械生产企业工艺用水控制情况的检查,提高企业工艺用水质量安全保证水平,依据《医疗器械监督管理条例》

《海南博鳌乐城国际医疗旅游先行区临床急需进口药品带离先行区使用管理暂行办法》已经3月24日海南博鳌乐城国际医疗旅游先行区领导小组会议审议通过,现印发给你们,请遵照执行

为深入贯彻落实中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),按照国家药品监督管理局《关于扩大医疗器械
《海南博鳌乐城国际医疗旅游先行区医疗机构制剂调剂使用管理暂行办法》已经3月24日海南博鳌乐城国际医疗旅游先行区领导小组会议审议通过,现印发给你们,请遵照执行。

为规范医疗器械注册人跨区域委托生产的监督管理,推进长江三角洲区域医疗器械跨区域监管,根据《中共中央办公厅国务院办公厅关于深化审评审批制度改革鼓励药品医疗器械创新的意见》《

附件:血液透析用水处理设备注册审查指导原则(2024年修订版)(2024年第19号).doc血液透析用水处理设备注册审查指导原则(2024年修订版)本指导原则旨在指导注册申请人对血液透析用水处理设备注册申报资料的准备及撰写,同时也为技术审评部门提供参考。本指导原则是对血液透析用水处理设备的一般要求,注册申请人依据产品的具体特性确定其中内容是否适用。若不适用,要具体阐述理由及相应的科学依据,并依据产

国家药监局关于发布免于进行临床评价医疗器械目录的通告(2025年第19号)发布时间:2025-05-13为做好医疗器械注册管理工作,根据《医疗器械注册与备案管理

关于发布医疗器械质量管理体系年度自查报告编写指南的通告(2022年第13号)发布时间:2022-03-24为加强医疗器械生产监管,保障医疗器械安全有效,根据《医

附件:一次性使用医用冲洗器产品注册审查指导原则(2022年第41号).doc一次性使用医用冲洗器产品注册审查指导原则本指导原则旨在指导注册申请人对一次性使用医用

为加强医疗器械生产监督管理,规范医疗器械生产质量管理,根据《医疗器械监督管理条例》(国务院令650号)、《医疗器械生产监督管理办法》(国家食品药品监督管理总局令第7号)
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台