国内凝血分析流水线产品盘点(沃芬/希森美康/思塔高和艾科达)
随着国家医疗改革的不断深入,使得综合性大中型医疗机构的中心实验室对自动化系统有了新的要求,为了简化检测流程,提高检测效率,保证数据准确度等,中心实验室对集中化诊断
来源:医疗器械注册代办 发布日期:2025-08-25 阅读量:次
为加强医疗器械监督管理,保障医疗器械产品质量安全有效,国家药品监督管理局组织对平衡训练设备、软性接触镜等5个品种进行了产品质量监督抽检,有6批(台)产品不符合标准规定。具体情况通告如下:
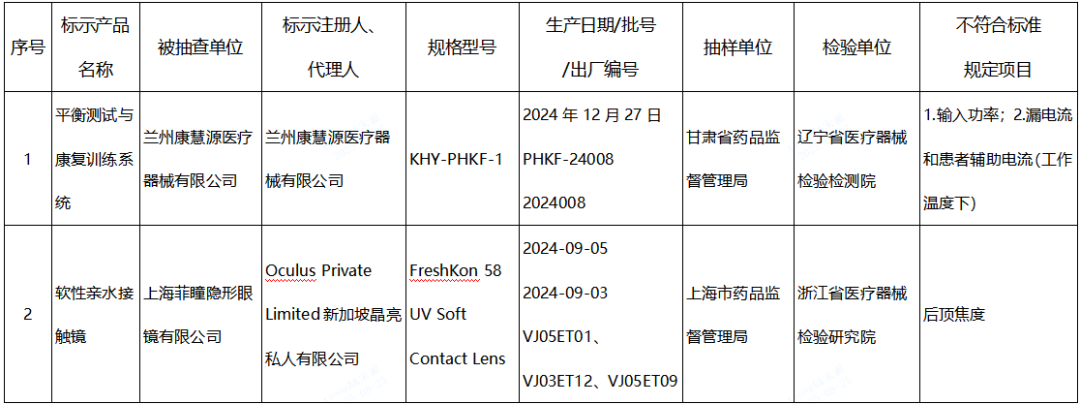
(一)平衡训练设备产品1台:兰州康慧源医疗器械有限公司生产,涉及输入功率、漏电流和患者辅助电流(工作温度下)不符合标准规定。
(二)软性接触镜产品1批:Oculus Private Limited新加坡晶亮私人有限公司生产,涉及后顶焦度不符合标准规定。
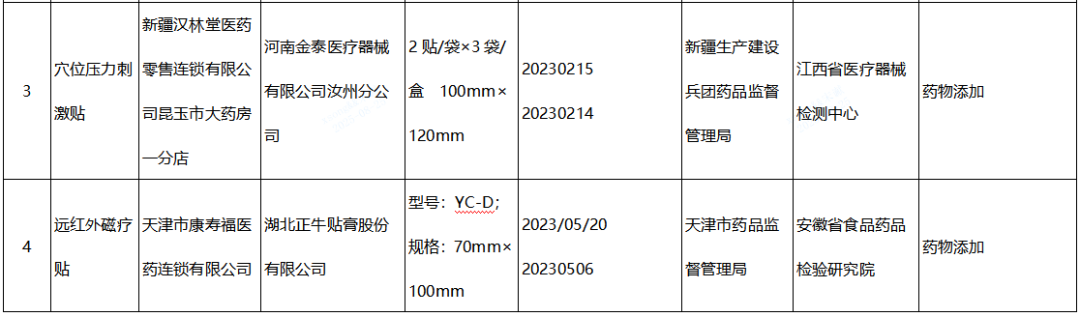
(三)贴敷类医疗器械(远红外治疗贴、磁疗贴、穴位磁疗贴、退热贴、穴位压力刺激贴)2批:分别为河南金泰医疗器械有限公司汝州分公司、湖北正牛贴膏股份有限公司生产,涉及检出“按照补充检验方法要求不得检出的相关药物成分”。
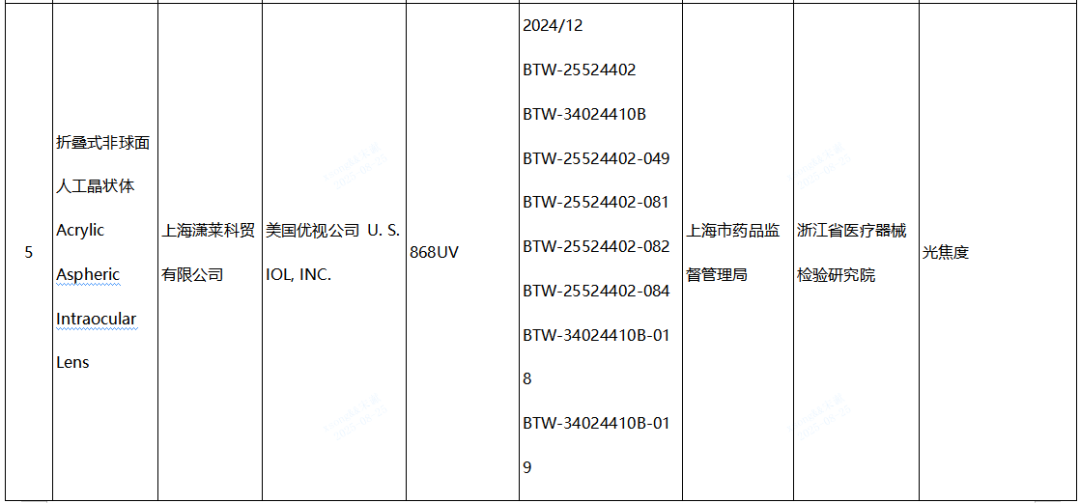
(四)人工晶状体产品1批:美国优视公司 U. S. IOL, INC.生产,涉及光焦度不符合标准规定。
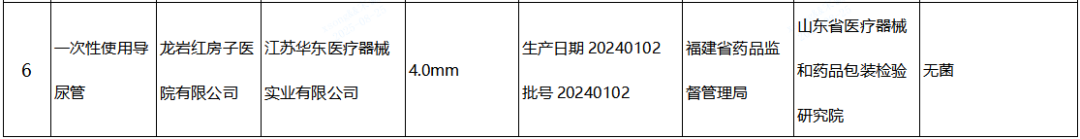
(五)一次性使用导尿管产品1批:江苏华东医疗器械实业有限公司生产,涉及无菌不符合标准规定。
以上抽检不符合标准规定产品具体情况见附件。
对抽检发现的不符合标准规定产品,国家药品监督管理局已要求企业所在地省级药品监督管理部门按照《医疗器械监督管理条例》《医疗器械生产监督管理办法》《医疗器械召回管理办法》等要求,及时作出行政处理决定并向社会公布。省级药品监督管理部门要督促企业对抽检不符合标准规定产品进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回产品并公开召回信息;督促企业尽快查明产品不合格原因,制定整改措施并按期整改到位。
特此通告。
附件:抽检不符合标准规定产品名单
国家药监局
2025年8月20日
附件
来源:NMPA

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

随着国家医疗改革的不断深入,使得综合性大中型医疗机构的中心实验室对自动化系统有了新的要求,为了简化检测流程,提高检测效率,保证数据准确度等,中心实验室对集中化诊断

润滑剂类产品在美国根据产品预期用途的不同主要分为人体润滑剂和患者润滑剂:其中,人体润滑剂主要成分为水、丙二醇、羟乙基纤维素、苯甲酸、卡波姆、氢氧化钠等,作用于生殖

FDA于2020.12.11发布了关于简短(Abbreviated) 510(k)申请的相关产品指南,该指南是在遵守“基于安全有效性途径”这一前提下编制提出的。在这个框架下,申请人若计划使用安全有效性途径提交

医疗器械注册费是行政性收费,按照注册单元收取,部分省份不收取医疗器械注册费用,绝大部分省份还是收取的。本篇文章统计了截止到2022年1月5日各地医疗器械注册收费标准。

以下对欧代、英代简单介绍,下期将针对欧洲注册、英国注册的要求推出详细的专题讲解,包括符合性声明、标签、文件等。"

日前,国家药监局发布《2018年度药品监管统计年报》(以下简称《统计年报》),该报告数据来源于《药品监督管理统计报表制度》,数据报告期为2017年12月1日至2018年11月30日。"

2016年起,医疗机构对有冷链要求的体外诊断试剂实施了入库验收制度,要求供应商按照医院规定的时间将产品送到科室,必须由试剂管理部门验收人员、科室人员双方一起验收,验收要

国家药监局器审中心关于发布定性检测体外诊断试剂分析性能评估等6项医疗器械产品注册审查指导原则的通告(2022年第36号) 发布时间:2022-09-28 为进一步规范定性检测体外诊断试剂分析

为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了《关节镜下无源手术器械产品注册审查指导原则》《一次性使用输尿管导引鞘注
为贯彻落实省委省政府关于鼓励支持医疗器械研究与创新的决策部署,加快创新医疗器械上市审批,促进新技术的推广和应用,推动医疗器械产业高质量发展,江苏省药品监督管理局决
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台