长江三角洲区域医疗器械注册人制度试点工作实施方案(试行)(沪药监械管〔2019〕112号)
为深入贯彻落实中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),按照国家药品监督管理局《关于扩大医疗器械
来源:医疗器械注册代办 发布日期:2024-01-18 阅读量:次
附件:人类免疫缺陷病毒检测试剂临床试验注册审查指导原则(2023年修订版)(2024年第4号).doc
本指导原则旨在指导注册申请人对人类免疫缺陷病毒检测试剂临床试验的设计及开展,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是针对人类免疫缺陷病毒检测试剂临床评价的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要详细阐明理由,并对其科学合理性进行验证,提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将适时进行调整。
人类免疫缺陷病毒(Human Immunodeficiency Virus,HIV)检测试剂是指利用免疫学及分子生物学等方法原理对人血清、血浆或其他体液中的特定的HIV生物学标记物,包括HIV 1型(HIV-1)p24抗原、HIV抗体、HIV核酸等进行定量或定性分析的试剂。
本指导原则适用于利用免疫层析法、化学发光法、时间分辨免疫荧光法、免疫印迹法等免疫学方法对HIV抗原和/或抗体进行定性检测的体外诊断试剂,以及应用分子生物学方法(如实时荧光聚合酶链反应等)对HIV核糖核酸进行定量或定性检测和分析的体外诊断试剂,适用于首次注册产品及申请变更注册的产品。
本指导原则不适用于国家法定血源筛查用HIV检测试剂。
临床试验的开展、方案的制定以及报告的撰写等均应符合相关法规及《体外诊断试剂临床试验技术指导原则》的要求,如相关法规、文件有更新,临床试验应符合更新后的要求。
(一)临床试验设计
1.临床试验机构及人员
申请人应选择不少于3家经医疗器械临床试验机构备案的临床机构开展临床试验。建议在选择临床单位时,综合流行病学背景、HIV的特性等因素选择临床试验机构,临床试验机构的实验操作人员应熟悉检测系统的各环节(仪器、试剂、质控及操作程序等),熟悉临床试验方案。
2.临床试验适用人群和样本类型
2.1适用人群
对于不同的检测试剂,其预期用途不同,因此入组人群亦不同。申请人应根据不同的要求入组适用人群开展临床试验。
对于HIV抗体检测、抗原抗体联合检测、HIV核酸定性检测试剂,预期用途为HIV感染的辅助诊断。入组人群应为疑似HIV感染的人群,包括具有HIV相关的症状/体征、以及有相关流行病学史的人群。应纳入HIV感染的不同进展阶段,包括急性期、无症状感染期及艾滋病期病例。为考察申报产品的特异度,临床试验中还应纳入可能会对试剂检测造成干扰的样本,如自身免疫病患者、类风湿因子(RF)阳性的病例、孕妇以及其他可能会造成交叉反应的病原体(乙型肝炎病毒、丙型肝炎病毒等)感染的病例等。对于HIV抗体检测第三代发光类试剂,应选择至少5套经过全面验证的阳转血清盘进行检测,对于抗原抗体联合检测第四代发光类试剂,应选择至少10套经过全面验证的阳转血清盘进行检测,以评价申报产品对于HIV感染早期的检出能力。对于抗原抗体联合检测试剂,为充分评价抗原的检测性能,应纳入至少10例单独抗原阳性的样本,如临床试验中难以获得,可使用商业化的血清盘进行检测。
对于 HIV RNA定量检测试剂,预期用途为通过对患者血清或血浆中人类免疫缺陷病毒核酸基线水平和变化情况的监测,用于评估抗病毒治疗的应答和治疗效果。入组人群应以已确诊HIV感染的病例为主,应包括正在接受抗病毒治疗的患者以及未接受抗病毒治疗的患者,确保样本HIV病毒载量覆盖申报产品的线性范围。同时应入组一部分阴性病例来考察其检测的特异度。如此类试剂预期用途除用于治疗监测外,还可用于HIV感染的辅助诊断,则还应按照上述关于辅助诊断预期用途的临床试验设计开展相应的临床评价。
对于HIV抗体检测试剂(免疫印迹法),预期用途为用于经HIV抗体筛查试验复检为有反应性的样本的确认。入组人群应以HIV抗体筛查试验复检为有反应性的病例。为了能够考察确证试剂的特异度,临床试验中应纳入一定数量的经确证试剂检测为阴性的人群。
我国境内流行的HIV主要为HIV-1型M组,其常见的基因型主要为B/B’、BC重组型(包括CRF 07_BC重组型和CRF 08_BC重组型)以及AE重组型(CRF 01_AE重组型)。在选择HIV感染者病例时,首先应根据HIV流行的情况,选择能代表我国不同地区流行基因型的HIV-1感染者病例,以对试剂检测我国流行的HIV-1病毒的能力进行客观科学的评价。抗体检测试剂以及抗原抗体检测试剂,常见基因型每种不少于10例。对于核酸检测试剂,每种常见基因型应至少30例,同时按基因型对样本进行亚组分析。对于我国境内罕见的基因型(1型O组、2型),也应进行适当验证,样本应经过科学的验证和确认,考虑到此类样本的不易获得性,样本可来源于HIV感染者,也可来源于经过科学验证的血清盘。
临床试验中还应注意纳入一定数量的低滴度/弱阳性样本。
2.2样本类型
样本类型一般为血清、血浆。如经临床前研究证明分析性能没有差异,例如血清和血浆样本,则临床试验中可进行汇总统计。对于口腔粘膜渗出液、尿液等体液样本,应单独进行临床评价。
临床样本的处理、保存和核酸提取等应分别满足申报产品说明书及对比试剂说明书的相关要求。
3.对比方法的选择
对于已有已上市同类产品的试剂,可选择境内已批准上市、临床普遍认为质量较好的同类产品作为对比试剂,采用试验体外诊断试剂与之进行对比试验研究,考察申报产品与对比试剂的一致性。对比试剂的选择应从预期用途、样本要求、检测性能等方面,确认其与申报产品具有较好的可比性。
对于无已上市同类产品的新HIV检测试剂,应采用试验体外诊断试剂与临床参考标准进行比较研究。临床参考标准即参照临床公认的临床诊疗指南、艾滋病诊断标准等进行病例诊断的方法。对于核酸定量检测试剂同时还应对其量值与疾病进展状况、转归、治疗情况等的相关性进行分析。
对于口腔粘膜渗出液、尿液等体液样本,无论申报产品采用何种检验方法,均应采用来自同一患者的血液样本进行同源对比试验。检测血液样本用对比试剂的检测性能应尽量高于申报产品。
4.最低样本量
临床试验样本量应采用适当的统计学方法进行估算,并详细描述所使用统计方法及各参数的确定依据。
对于抗体检测、抗原抗体联合检测以及核酸定性检测试剂,此部分临床试验目的为评估两种检测方法之间的一致性,因此建议采用单组目标值法公式进行最低样本量的估算。通过阳性符合率和阴性符合率来分别计算所需阳性样本和阴性样本的例数。阳性、阴性符合率的临床可接受标准(P0)一般建议不低于98%。
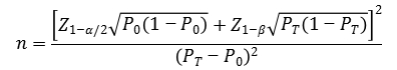
公式中,n为样本量;Z1-α/2、Z1-β为显著性水平和把握度的标准正态分布的分数位,P0为评价指标的临床可接受标准,PT为申报产品评价指标预期值。
对于核酸定量检测试剂,也应选择合适的样本量估算的方法进行最低样本量的估算。应注意所纳入的临床样本应覆盖申报产品的线性范围。
5. 统计分析
5.1定性检测试剂
应选择合适的统计方法对临床试验结果进行统计分析,对于定性检测的一致性评价,常选择交叉四格表的形式总结两种方法的结果,评价指标一般包括阳性符合率/灵敏度、阴性符合率/特异度,Kappa值等,并计算相应的95%置信区间。
对于两种方法检测不一致的样本,应采用临床参考标准或其他方法再次进行确认或提供临床诊断资料以进一步明确受试者(采集样本时)所处的感染状态,同时结合患者的临床症状/体征对差异原因及可能结果进行分析,从而对申报产品的性能进行客观科学的评价。
5.2核酸定量检测试剂
5.2.1应根据临床试验数据绘制散点图,进行相关性分析。
5.2.2采用Bland-Altman法,计算一致性限度,评价两种检测结果的一致性。一致性限度应在临床所能接受的界值范围内。
5.2.3 采用回归分析对两种检测方法的一致性进行评价。应根据数据分布特点等因素选择适用的回归分析方法,如Passing-Bablok回归、Deming回归和最小二乘回归等。回归分析应重点观察回归方程的回归系数和截距等指标,计算回归系数和截距的95%置信区间。
5.2.4 选择交叉四格表的形式总结两种试剂的定性检测结果,计算阳性符合率、阴性符合率和总符合率、Kappa值等,并计算相应的95%置信区间。
(二)通用要求
1.临床试验方案
临床试验实施前,研究人员应从流行病学、统计学、临床医学、检验医学等多方面考虑,设计科学合理的临床试验方案。各临床试验机构应执行统一的临床试验方案,且保证在整个临床试验过程中遵循预定的方案实施,不可随意改动。整个试验过程应在临床试验机构的实验室内并由本实验室的技术人员操作完成,申请人的技术人员除进行必要的技术指导外,不得随意干涉试验进程,尤其是数据收集过程。
试验方案中应确定严格的病例纳入/排除标准,任何已经入选的病例再被排除出临床试验都应记录在案并明确说明原因。在试验操作过程中和判定试验结果时应采用盲法以保证试验结果的客观性。
2.质量控制
临床试验开始前,建议进行临床试验的预试验,以熟悉并掌握相关试验方法的操作、仪器、技术性能等,最大限度控制试验误差。整个试验过程都应处于有效的质量控制下,最大限度保证试验数据的准确性及精密度。
3.临床试验报告
临床试验报告应该对试验的整体设计及各个关键点给予清晰、完整的阐述,应该对整个临床试验实施过程、结果分析、结论等进行条理分明的描述,并应包括必要的基础数据和统计分析方法,最后得出临床试验结论。
[1]国家市场监督管理总局.体外诊断试剂注册与备案管理办法:国家市场监督管理总局令第48号[Z].
[2]国家药品监督管理局.关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告:国家药品监督管理局公告2021年第122号[Z].
[3]国家药品监督管理局.体外诊断试剂临床试验技术指导原则:国家药品监督管理局2021年第72号[Z].
[4]国家药品监督管理局.体外诊断试剂临床试验报告范本:国家药品监督管理局2022年第21号[Z].
[5]原国家食品药品监督管理总局.体外诊断试剂说明书编写指导原则:原国家食品药品监督管理总局公告2014年第17号[Z].
[6]WS-293-2019,艾滋病和艾滋病病毒感染诊断标准 [S].
[7]中华医学会感染病学分会艾滋病丙型肝炎学组 中国疾病预防控制中心.中国艾滋病诊疗指南(2021版)[J],中国艾滋病性病, 2021,27(11):1182-1201.
[8]中国疾病预防控制中心.全国艾滋病检测技术规范(2020年修订版)[Z].

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

为深入贯彻落实中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),按照国家药品监督管理局《关于扩大医疗器械

为规范医疗器械注册人跨区域委托生产的监督管理,推进长江三角洲区域医疗器械跨区域监管,根据《中共中央办公厅国务院办公厅关于深化审评审批制度改革鼓励药品医疗器械创新的意见》《

2024年10月19日,在第 75 届世界医学会全体大会上正式通过了《赫尔辛基宣言》的最新修订版本;《赫尔辛基宣言》作为人类参与者的医学研究伦理

附件:血液透析用水处理设备注册审查指导原则(2024年修订版)(2024年第19号).doc血液透析用水处理设备注册审查指导原则(2024年修订版)本指导原则旨在指导注册申请人对血液透析用水处理设备注册申报资料的准备及撰写,同时也为技术审评部门提供参考。本指导原则是对血液透析用水处理设备的一般要求,注册申请人依据产品的具体特性确定其中内容是否适用。若不适用,要具体阐述理由及相应的科学依据,并依据产

附件:医疗器械监督管理条例(2025年修订版).doc医疗器械监督管理条例(2000年1月4日中华人民共和国国务院令第276号公布 2014年2月12日国务院第

附件:医用透明质酸钠创面敷料注册审查指导原则(2024年第21号).doc医用透明质酸钠创面敷料注册审查指导原则本指导原则旨在指导注册申请人准备及撰写医用透明质酸钠创面敷料注册申报资料,同时也为技术审评部门审查注册申报资料提供参考。本指导原则是对医用透明质酸钠创面敷料产品的一般要求,注册申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对

国家药监局器审中心关于发布影像型超声诊断设备(第三类)注册审查指导原则(2023年修订版)的通告(2024年第29号)发布时间:2024-10-14为进一步规范

国家药监局药审中心关于发布《抗肿瘤药物临床试验中SUSAR分析与处理技术指导原则》的通告(2024年第42号) 发布日期:20241010

附件:医用雾化器注册审查指导原则(2024修订版)(2024年第19号).doc 医用雾化器注册审查指导原则(2024年修订版) 本指导原则旨在指导注册申请人提交医用雾化器的注册申报资料,同时也为技术审评部门审查注册申报资料提供参考。 本指导原则是对医用雾化器的一般性要求,注册申请人应根据申报产品的特性提交注册申报资料,判断指导原则中的具体内容是否适用,不适用内容应阐述理

附件:大便隐血(FOB)检测试剂盒(胶体金免疫层析法)注册审查指导原则(2024年修订版)(2024年第21号).doc大便隐血(FOB)检测试剂盒(胶体金免疫层析法)注册审查指导原则(2024年修订版)本指导原则旨在指导注册申请人对大便隐血(FOB)检测试剂盒(胶体金免疫层析法)注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。本指导原则是对大便隐血(FOB)检测试剂盒(胶
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台