医疗器械注册单元划分概述——注册单元划分常见问题解答
从事医疗器械注册的小伙伴们可能都为同一个问题苦恼过,那就是医疗器械注册单元的划分。企业所设计开发出的产品,其所包含的产品范围,是否可通过一个注册单元完成注册,从而
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次

年底新的一波面试潮即将来临,那该如何准备呢?此前,查阅许多文章、法律法规,并结合面试经验及行业大佬的指点,总结了面试可能遇到的问题分享给大家。
首先:“所谓“知己知彼百战百胜",要先清楚面试官想要什么样的候选人。一般要具备三个条件:(1)强烈加入的意愿;(2)能够独立做事,既可以发现问题,解决问题,又可以预防风险的发生;(3)团队协作,说白了就是你和面试官聊得来吗?跟这个团队气场是否相符?
其次:了解面试问题的构架:一般情况monitor skill 占比60%,monitor skill包括各种监查技能。soft skill占比40%,Soft skill包括积极性、抗压力、性格如何、解决问题的能力及强烈加入的意愿等。
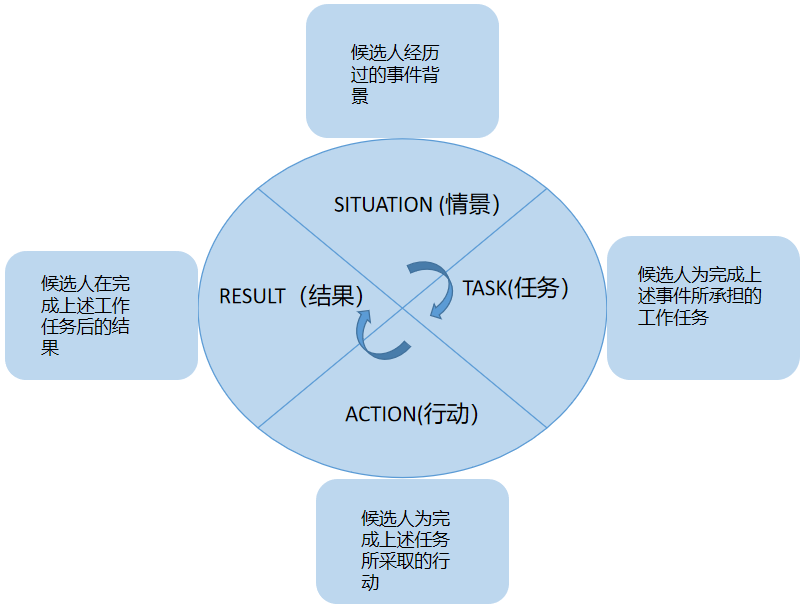
最后:回答问题要具有逻辑性,并在适当时机展现自己的闪光点。如何回答问题才有逻辑性呢?当面试官询问某个issue怎么处理时,采用这两步法的思维方式进行回答,一般都会回答得比较完善,至少可以拿80分左右。第一步先进行root case analysts,一般有鱼骨法或者 5 whys。第二步针对原因,采取CAPA措施。当面试官让你分享Case时,采用STAR法则回答(见下图)。S代表SITUATION(情景),描述事件的背景。T代表TASK(任务),分条描述当时你所接到的工作任务。A代表ACTION(行动),为了完成任务,你采取哪些行动,此处面试官想看看你解决问题的能力。R代表RESULT(结果),采取行动后,事件的结果怎么样。
以上是如何准备面试的整体思路,接下来汇总了十几个面试问题供大家参考。
Hi everyone, I’am very glad to have this opportunity to introduce myself. I’m XXX. I graduated from XXX medical university.
In the last XXX years, I have worked at XXX, As a CRA, Responsible for monitoring multiple Phase I, II, III & IV clinical trial sites, across different therapeutic areas, and assisting other CRA with co-monitoring activities on-site. Responsibilities include assisting with site selection, pre-trial assessment, subject recruitment and retention planning, site initiation, on-site monitoring and close-out activities. Ensures that clinical drug supplies are appropriately used, handled and stored and returns are accurately inventoried and documented. I not only ensured the quality and progress of these trials, but also made grate achievements in enrollment. Besides, establish good cooperation with site staff and cross-functional teams on also my responsibility. I pursue the career path development in clinical trial, and have constantly strengthening my professional skills.
The purpose of this interview is to go further on the road of CRA and enhance core competitiveness in different projects and training. I hope your company can give me an opportunity to show myself, thanks for your listening.
GCP的宗旨包括两个重要方面:其一,保护受试者的安全、健康和权益;其二,保证临床试验结果的准确性和可靠性。
A standard for the design, conduct, performance, monitoring, auditing, recording,
analyses and reporting of clinical trials that provides assurance that the data and
reported results are credible and accurate, and that the rights, integrity and
confidentiality of trial subjects are protected. (ICH-E6, 1.24)
Ensures the rights, safety and well-being of trial subjects are protected.
Ensures the data from the trial are complete, accurate, and unbiased.
1、在试验前确认临床试验机构已具有参与临床试验的资格,包括人员配备与培训,实验室设备齐全,工作情况良好,预期有足够的受试者。
2、在试验前、中、后期监查机构和研究者是否遵从已批准的临床试验方案、相关法规和SOP。
3、确认每位受试者在参与实验前签署知情同意书,了解受试者的入选情况及试验的进展情况。对研究者未能做到的随访、未进行的试验、未做的检查。以及是否对错误、遗漏做出纠正等,应当清楚、如实记录。对修订的知情同意书,确认未结束访视并受影响的受试者重新签署。
4、核对病例报告表录入的准确性和完整性,并与源文件比对。应当注意核对试验方案规定的数据在病例报告表中有准确记录,并与源文件一致。
5、确认所有SAE在规定的时间内上报告并记录在source document。
6、负责对IMP的运输、接收、储存、分发、处理、回收过程进行监查。
7、监查临床试验过程中相关设备的定期维护与校准。
8、每次监查后应当书面报告递送申办者,报告内容应当包含监查日期、时间、监查员姓名、监查地点、研究者姓名、监查内容、项目完成情况、监查的发现、事实、偏离、结论以及对错误遗漏做出的纠正等。
Main line of communication between investigator and sponsor. Verify the Investigator has adequate qualifications and resources to conduct the trial and supervise properly. Verify if IP complies with applicable regulatory requirement(s) and site uses it in accordance with sponsor guidance (e.g. storage conditions, subject instructions, distribution and disposition). Verify if informed consent process occurs prior to subject’s participation in a trial. Ensure the investigator receives current investigator brochure (IB) and all other documents, and supplies needed to conduct trial.Confirm eligible subjects are enrolled.Verify if source documents are completed based on ALCOA-C principles and maintained. Confirm the accuracy and completeness of CRF entries, source documents, and other related records. Confirm all adverse events have been reported appropriately. Ensure maintenance of essential documents. Communicate deviations to the Investigator (& sponsor) and work to prevent future occurrences.(ICH GCP 5.18.4)

第一步:远程电话调研中心合作意愿,包括PI和机构意向。若表示有意向,与PI及机构约拜访时间,发送拜访确认函。CRA需提前熟悉方案、研究者手册;需提前在官网及微信公众号查阅该中心机构和伦理流程。
第二步:中心筛选访视时,主要关注点有以下五方面:
1、“法规要求”:PI是否在药物临床试验机构备案系统备案。机构是否备案?
2、“入组速度”:入组限速因素主要考虑的点:科室竞争试验情况、目标患者数量、目标患者入组速度、PI与牵头研究者关系、研究者影响力、研究者对试验的兴趣度、研究团队情况、PI既往项目经验、PI时间是否充裕、研究者积极性等。
3、“启动速度”:影响中心启动速度的因素包括伦理上会频率、立项流程及要求、伦理审查流程及要求、合同签署流程及要求。
4、“试验质量”:包括既往项目质量情况(例如既往稽查情况)、PI既往项目经验、研究团队情况。
5、“设施、设备”:包括是否有项目所需所有检查,医院对应的检查设备是否完整。也包括科室的一些项目相关的条件与设施情况,例如是否有研究资料保存的文件柜、低温离心机、-70℃/-20℃冰箱、2-8℃恒温箱等。
第三步:拜访后跟进工作包括: 及时撰写PSV。相关文件回收:CDA、可行性调查问卷、CV、FD、Medical license、GCP certificate等。发送follow up letter 给研究者和CRC。
SQV/PSSV Preparation: Confirm availability of all key study staff. Send formal written confirmation of visit containing agenda, date/time, location, and site staff with whom you need to meet. Review study protocol (study design, inclusion/exclusion criteria, study procedures).
The site visit confirmed the following points: Qualification of principal investigator and site staff(Education and training/Indication experience/Clinical trial experience);Patient population and recruitment strategies;Recruitment period and recruitment expectations. Resource availability (Other ongoing/competitive studies or activities/Time dedicated to other activities, such as, classes, private clinic/ Number of sub-investigators/Study coordinator or other needed personnel assigned). Adequate space, restricted access Exam and general procedures room. Number of beds for hospitalization. Local Laboratory (certified?) and storage room for supplies and samples collection; Equipment (e.g. x-ray, bone scan, ECG); Frequency of IRB/IEC meeting; SAE management; Assess investigator’s interest in the study.
SQV/PSSV Follow-up:Complete qualification visit report. Process documents collected as required by the sponsor. Follow-up on all questions raised during the visit. Write follow-up letter that includes all topics discussed, items agreed, open items/issues with due dates and owners, and other sponsor requirements.
SIV的准备工作包括:
1、系统方面:CTMS系统(更新中心的状态,添加人员的联系方式和职责、添加计划、添加文件、地址邮编等信息)、IWRS系统(给研究者/CRC开通账号)、EDC(给研究者和CRC开通账号)系统等开通。
2、文件方面:准备启动会相关文件(比如:会议签字表、培训记录表、授权表、site vist log、药物及生物样本相关表格等)。
3、药物、物资方面:确认药物存储地点;确认中心是否有药物恒温箱、温度计、转运箱和低温冰箱等,如果没有,需提前一个月向项目组申请购买,确保启动会前到达中心。确认Lab kits,ISF文件夹,文件柜、打印机等已到达中心。
4、预约启动会时间、地点、参会人员(主要研究者团队、机构、其他科室比如影像科)。

SIV执行工作包括:
1、提前了解研究者的喜好,预定餐饮。至少会前一小时到中心布置会场和调试设备。提前预演PPT。提前与CRC分配任务,以保证启动会顺利开展。
2、会议中讲解PPT,重点内容有:目的、方案设计、试验流程、入排标准、AE、SAE相关处理及上报。启动会上及时解答研究者问题并做好会议记录。会议结束时及时回收并整理相关签字文件。
3、实地考察药房:确认接收、存储、管理、退还、处置与销毁IMP的流程。考察实验室:依据方案确认实验室的检验分析、仪器校准、样本管理和留存、报告结果放行等流程。
启动会后跟进工作包括:及时撰写SIV,回收启动会相关文件并归档。向研究者反馈会上所提疑问的解决办法及预防措施,与研究者沟通入组可能遇到的问题。发送follow up letter 给PI和CRC。
SIV Preparation:Confirm if study site has received all study related material and has access to all applicable systems (EDC/IWRS). IP and instructions delivered to site. Contact site to schedule a date (as soon as possible). Confirm availability of all key study personnel. Review study protocol (study design, inclusion/exclusion criteria, study procedures), as well as the case report form and study reference manual.
SIV Review & Discussion:PPT should be explained well. Especially the study objectives, inclusion and exclusion criteria,test process and nodes,which should be explained clearly to the investigators. On-site essential document review. Confirm site staff member roles and delegated responsibilities.
SIV Follow-up:Follow-up on all questions raised during the visit. Complete initiation visit report. Per ICH GCP a copy of SIV report must be archived in the investigator site file (ISF). Process documents collected as required by the sponsor. Write follow-up letter that includes all topics discussed, items agreed, open items/issues with due dates and owners, and other sponsor requirements.

MV准备工作包括:整理上次以来未解决的问题,做一个Check list(截止上次监查以来的新的SDV有哪些?准备需要递交EC的PD、药检报告等文件。有哪些新入组的病人?)。准备从上次以来需要上报伦理的文件。预定机票、查询天气、准备出差物品等。与研究者和CRC预约拜访时间后,发送Conformation letter。
On site 监查工作内容包括:
1、首先要对ICF进行监查,确认在试验前所有受试者或者其监护人均签署了知情同意书。(详情见下文知情同意书监查要点)
2、SDV和SDR:针对受试者的病历、ICF、日记卡、CRF、药物发放回收记录表、血样记录表、阅片中心等记录进行SDV。SD记录要符合美国FDA的ALCOA-C原则和欧盟的CCEA原则。
3、对药物、物资、生物样本进行核查:(1)核查药物的接收、发放(发药时间、剂量、药物号等)、使用(参照受试者日记卡)、保存(按药物保存温度要求存放)、库存(数量正确)、回收等是否符合方案要求及GCP要求。药物库存是否充裕。查看药检报告。(2)物资是否充裕,使用数量是否正确。(3)关于生物样本:样本的采集处理、储存条件、运输条件、使用是否符合方案要求?
4、PD的管理:发现偏离方案和GCP的事件,根据PD list 鉴别是属于minor 还是Major。不同程度的PD采取的解决方案不一样。
5、不良事件的管理:确认是否有新发生的AE/SAE/susar/特别关注的不良事件等。查看AE是否漏记,根据CTCAE的要求去查看AE记录是否完整,AE是否申办方PV部门?SAE是否按要求在24小时内上报?随访信息是否上报?
6、进行文件方面的监查:(1)Check ISF文件夹至少包括:伦理审查递交信、批件完整;方案、ICF、IB等版本完整,并均已递交EC。若有版本更新,需对相关人员培训并做好记录。药检报告及时备案且有效期覆盖试验范围。确认SAE报告内容真实且可追溯并进行了追踪。(2)Check受试者文件夹至少包括:核查ICF、身份证、既往病史、治疗史、历次检查报告单、CS/NCS临床判断、AE转归是否有证据、病历、医嘱单、用药记录等、退出试验有退出记录、死亡记录等。
7、针对此次监查发现的问题,与研究者的沟通解决。与研究者沟通督促入组。若有方案、IB、ICF版本更新的情况,需要对研究者及CRC进行再次培训,并将培训记录保存在ISF中。
MV后跟进工作包括:及时撰写MVR;监查后3天内发送拜访跟进函。及时上报PD。及时将此次监查回收的文件归档至eTMF。
IMV Preparation:Review the monitoring plan, CRF/eCRF completion guidelines, study reference manual. Review the protocol, protocol amendments, and changes to study procedures since the last visit.Confirm access to all required patient records. Make your travel arrangements as soon as allowed Review all electronic systems (e.g. TMF, EDC, IRT).
IMV During Visit:ICF and AE/SAE review are priorities. Review of 100% of all ICFs and confirmation that all versions of the ICFs are present and have been signed correctly and contemporaneously by each subject. Review of new subjects are a priority. Source document review (SDR)/source data verification (SDV):There is a source entry for each visit and each phone contact with the subject. Drug accountability, reconciliation to be consistently and contemporaneously verified. Review ISF to confirm:IRB/IEC approvals and re-approvals all remain active and Current. Ongoing reports and protocol deviations have been submitted to IRB/IEC. Maintenance of essential documents. Protocol Deviations Management:Ask management if there are any premade tools to assist in the identification and documentation of issues, root causes, action plans. Confirm adverse events and concomitant medications are accurately captured on the CRFs.
IMV Follow-up:Discuss with PI any identified issues, resolution timelines, task ownership. Follow-up of issues previously identified. Complete monitor visit report.
关中心是一个动态的过程,一般在最后一个病人完成最后一次访视后,当然,还有些特殊情况下(比如:质量问题,或者入组困难等种种原因)提前关中心,我们就会进入到项目结束阶段,这个阶段我们需要做的事情包括:数据清理,数据核查,锁库,遗留问题解决,财务结算,文件归档,药物/血样/物资回收,统计分析等。关中心需完成的任务至少包括以下几方面:
1、数据方面:确认所有数据已录入,SDV已完成,所有query已经的到妥善答复。确认数据澄清表已填写完成,并签字。然后进行数据锁库。
2、财务方面:核对医院打款、发票回收、受试者检查费、交通补助等。然后进行财务结算,填写经费清算表格,PI审核后发送机构审核。
3、文件方面:清点ICF数量;确认ISF/TMF目录规定的所有文件已经收集并保存;确认需要递交伦理的文件均正确,递交信日期无误。确认财务合同及发票无误。
4、不良事件管理方面:确认所有的AE报告完整且正确。确认所有SAE上报。确保这些文件都已存档。
5、药物、物资、生物样本清点/回收: 确认数量对得上、剩余药物被妥善回收或销毁、相关药物的文件已归档,确认药物记录信息完整、资料齐全符合关中心要求。
6、项目自查、第三方稽查:申办者/CRO对项目进行自查,填写《自查数据表》及关中心《自查表》。稽查和自查并整改后申办者可向机构办递交《临床试验关中心函》。
7、科室/机构质控:按中心要求《关闭中心及研究资料归档要求》整理归档资料完毕,提前一周预约机构质控员进行项目关中心质控,机构质控员确认问题已全部整改,符合关中心要求后在《结题签认表》中签字。
8、按照中心要求填写分中心小结/总结报告。(递交临床试验结题分中心小结/总结报告,机构复核签字盖章。
9、预约机构档案管理员进行研究资料归档。
10、及时完成COV报告。
COV Preparation:Performed when all subjects have completed study,All data submitted and declared “clean” by data management. Review latest IMV Report (confirm that there are no queries and/or unresolved issues). Review ICH GCP Section 8 for required essential documents.Contact site to schedule a date (as soon as possible).
COV During Visit:Confirm all signed ICFs are filed. Ensure the following documents are accurate and filed at site(SAE forms (including safety reports) ,CRFs ,Data clarification forms ,Regulatory documents (approvals, IRB/IEC partial reports). Confirm 100% of accountability of study medication and ensure a complete reconciliation. Confirm IP return/destruction procedures are Followed.If not provided by the sponsor/EDC, create a list with all AEs/SAEs persisting at the subjects last study visit. Review financial disclosure form requirements. Review potential audit or inspections.
COV Follow-up:Follow up all questions raised during the visit Complete Close-out Visit Report. Write follow-up letter that includes all topics discussed, items agreed, open items/issues with due dates and owners, and other sponsor requirements.

首先从合并用药、受试者日记卡、受试者主诉、研究者开放式提问、体格检查、实验室检查出现异常值有临床意义等,来发现AE和SAE。例如:监查发现合并用药,一定了解使用合并用药的原因。
如果发现AE,查看研究者是否对患者进行安全性评估?是否在研究病历中记录AE/SAE(需要记录:名称、临床诊断、发生时间、严重程度、处理措施、与药物相关性、随访情况(时间、结果))。若发生SAE,研究者需要立即上报本中心伦理和申办方。监查过程中如果发现研究者未按要求进行记录和上报,需要对研究者进行再培训,并保存培训记录。记 PD并上报伦理。
Any untoward medical occurrence that at any dose(ICH E6 1.50 and ICH E2A II.B):
• results in death
• is life threatening
•requires inpatient hospitalization or prolongation of existing hospitalization
• results in persistent or significant disability / incapacity
• results in congenital anomaly/birth defect
• is a medically important event
SAE上报要求:当研究者获知SAE后,研究者应当立即向申办者和本中心伦理委员会书面报告所有严重不良事件,随后应当及时提供详尽、书面的随访报告。
第一步:转运箱中放入温度计和冰袋预冷30min,开启温度计。
第二步:如果温度降到小于8℃,CRC或者研究护士去GCP药房取药。如果温度未降到8℃以下,将接着预冷至8℃以下时,CRC或者研究护士进行取药。
第三步:到达科室,查看温度计是否有超温报警,如果无超温,联系授权护士是否可以立即配药。如果可以立即配药,停止温度记录,记录取出来的时间,打印温度记录归档。如果授权护士暂时很忙,这时候不能停止温度记录。等待研究护士说可以配药时,停止温度记录,记录取出来的时间,打印温度记录归档。

药物超温分两种情况:
第一种:超温药品未发给受试者,隔离药品,找到药物超温的的原因(例如:温度计、冰箱是否在校准日期内?温度计所放位置是否适当?线路老化?),发超温报告给申办方评估是否可用?如果可用,备案EC,解封药物。如果不可用,备案EC,销毁/回收。
第二种:超温药物发放给受试者,隔离药物,找到药物超温的的原因,发超温报告给申办方评估是否可用?如果可用,备案EC,解封药物。如果不可用,药物超温备案EC ,受试者服药备案伦理,让受试者来中心进行安全性评估,药物销毁/回收。
首先查看药物转运至中心的过程,运输过程是否超温,确认实际接收数量和申请数量是否一致,包装是否完整。若确认无超温,数量一致,包装完整,导出温度报告表归档ISF。
其次查看药物接收发放表,药物库存表及温度记录表等,核对药物接收(数量)、储存(温湿度情况)、分发(数量是否一致,批号是否正确)、回收(数量是否对得上,空盒,未用药物数量是否正确)、整个流程的管理。
最后查看相关文件是否符合要求:COA是否备案EC,温度计和冰箱是否在校准日期内,药物发放回收表格是否按要求填写,药物管理员是否被授权,是否被培训,培训记录是否已归档?切记:过期药物、包装破损药物不能发放给患者。还需要注意:药物发给患者时不过期,患者服用一段时间后还有未服的药物过期了,但还没到下一次访视发药时间,这种情况也是不允许的。
1、ICF是否存在缺页、少页,掺杂错页或排版错误?ICF的版本号和版本日期是否当前被伦理批准的最新版?新版ICF是否给研究者培训,培训记录是否归档?确认未结束访视并受影响的受试者是否重新签署新版ICF?
2、ICF 是否给到患者一份?如果研究病历如果书写已给到患者,默认已给到患者。
3、ICF签署时间的问题:无特殊情况下,知情同意书的签署是否先于任何研究程序。
4、知情过程是否被详细记录在研究病历中。
5、ICF上信息填写是否正确和完整?
6、筛选失败患者的ICF是否被保存?
7、患者签字:ICF签字是否是本人签署?如果是家属签署,需注明关系,并注明非本人签署的原因,但已充分知情告知,同意参加该研究,请某某代签。医生签字:是否是医生签字,需检查该医生是否被授权?授权时间先于知情时间,无不符合常规的签字,通过其他原始文件进行cross check 签字笔迹。
8、无行为能力的受试者应由其法定代理人代表其实施知情同意并签名签署日期。应在符合受试者理解的范围内告知受试者,若受试者有能力,应在书面知情同意书上亲自签字并注明。若受试者或者其监护人缺乏阅读能力,应当有一位公正的见证人见证整个知情同意过程。见证人还应当在知情同意书上签字并注明日期。
Review of 100% of all ICFs and confirmation that all versions of the ICFs are present and have been signed correctly and contemporaneously by each subject, review should include also: Current version approved by IRB/IEC has been used. ICF process is recorded in source document. Confirmation ICF was signed prior to any study procedure. Documentation subject received a copy of the ICF. Are all pages of the consent present? Count the pages to ensure that a page did not get missed, lost or misplaced. Did the Site Staff personally sign and date the informed consent? Review pen color, handwriting, and compare to the handwriting on the delegation log.
预祝各位小伙伴拿到心仪的offer!
作者:医药小A

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

从事医疗器械注册的小伙伴们可能都为同一个问题苦恼过,那就是医疗器械注册单元的划分。企业所设计开发出的产品,其所包含的产品范围,是否可通过一个注册单元完成注册,从而

众所周知,“肿瘤项目经验”这几年了CRA跳槽市场上的“硬通货”,本文将对其中的肿瘤评估表进行介绍,希望能将自己的监查经验以及对RECIST 1.1(实体肿瘤的疗效评价标准 1.1版)及

CRC的能力提高能提升与CRA的工作配合度,也能提高项目的质量并加快项目进度。同时CRC的水平提高也成就了CRC-CRB-CRA的转变。CRC的工作效率也直接关系到CRA的工作效率,比如方案修正案递

刚接触医疗器械CRO行业的小伙伴,在学习文件法规资料的同时,常看到一些英文类专业名词不知道是什么意思。下面,一起看看常见的医疗器械临床试验专业术语......"

每年临研人才市场最为热闹的3、4月份就要来了。很多粉丝朋友都是跟着我从CRA一路走到PM的,相信也有不少人下一个职业生涯的目标也是PM这个岗位。凑巧的是,我正好在前段时间经历

CRA往往面临着两轮或三轮的面试要求,HR面试和项目经理面试,有些优质CRO公司甚至遭到部门副总的第三轮接待。我起初是不情愿解答这些问题,担心解答不好误人子弟。以下是潇潇兮同

2019-12-01药物临床试验机构(简称机构)开始实行备案管理。本文结合机构备案平台构建思路,着重介绍了备案平台的结构组成以及相关要求,梳理了机构备案过程中的常见问题,对机构

在中国临床研究行业经历了高速发展的10年后(2004年-2014年),进入了一个相对平稳的时期。如果早期进入临床研究的CRA,在自己坚持不懈努力的情况下,今天基本都做到了项目经理,总

监查员行业人员流动性大,这就让我们需要经常面对项目的交接工作,如何让工作交接不出问题,接任CRA后面少填坑,让后续工作得以顺利推进,给大家提供以下五个要点

随着越来越多的临床试验中都配备 CRA,CRA 与 CRC 在临床试验中的作用及合作值得大家一起探讨。首先,介绍一下在项目运行中可能出现的问题和矛盾,间接影响了项目的执行和质量。希
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台