有源医疗器械加速老化试验效期验证及使用期限验证流程
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有
来源:医疗器械注册代办 发布日期:2021-08-22 阅读量:次
原创:小药丸
9月18日,国家药品监督管理局发布通告,出台了《晚期非小细胞肺癌临床试验终点技术指导原则》,旨在规范和指导我国治疗晚期非小细胞肺癌药物的临床试验设计和终点选择,提供可参考的技术规范。《原则》所涉及的观点代表了当前NMPA对晚期NSCLC临床试验设计和终点选择的审评认识,适用于支持晚期NSCLC适应症注册的临床试验设计及终点选择,NMPA鼓励研发从业人员探索科学创新的终点和试验设计,并及时与NMPA的审评部门沟通和交流。
肺癌是中国和世界范围发病率最高的癌症,据统计,2015年中国新发肺癌病例约78.7万人,死亡63.1万人。其中,非小细胞肺癌(NSCLC)约占肺癌总体的85%。
早期肺癌患者预后较好,但由于肺癌确诊时多数患者分期较晚,肺癌患者整体的五年生存率仅20%左右,生存率亟待提升,整个肺癌领域尚存在较大的临床需求未被满足。
从1997年EGFR抑制剂进入临床到目前多个药物一线治疗地位的确立,经历了20多年的时间。

数据来源:公开资料整理
2018年,国内新增了320项肿瘤临床试验,同比增长56%,其中新增I期临床试验数量149个、新增II期临床试验数量69个、新增III期临床试验数量98个。新增试验共招募患者规模达到49517人,涉及到293个药物。
按照肿瘤种类分类,非小细胞肺癌的新增临床试验数量最多,达到47项,招募患者人数9116,试验人数最多,遥遥领先于其他瘤种。
就整体的临床治疗而言,现阶段晚期NSCLC的治疗目标是延长患者生命,提高生活质量。
总生存期(OS)是反映NSCLC患者生存获益的直接终点,其临床意义重于无进展生存期(PFS)等替代终点。在后续治疗均衡的情况下,现阶段国内外专家考虑认为,在转移性肺鳞癌中,2.5个月以上OS获益被认为具有显著的临床价值,非鳞癌中3.25个月以上的OS获益被认为具有显著的临床价值,目标HR的点估计值通常不高于0.80。通常将风险比和中位获益结合评价,认为两者均达到具有更稳健的OS获益。
近年来,小分子酪氨酸激酶抑制剂、抗血管生成药物和免疫检查点抑制剂的应用已显著提高了NSCLC患者的生存,是现阶段主要的三大类型治疗药物。
EGFR-TKI是目前治疗EGFR突变阳性NSCLC患者的最有效药物,截止目前EGFR-TKI已开发至第三代。代表性药物为2015年上市的三代 EGFR-TKI奥希替尼,凭借优异的临床疗效目前已经成为EGFR突变NSCLC一线治疗的新标准。未来,EGFR-TKI通过与化疗药物联合使用,进一步延长晚期NSCLC患者的生存期是这类药物发展的主要方向之一。
目前,用于NSCLC患者治疗常见的抗血管生成药物为贝伐珠单抗、雷莫芦单抗及安罗替尼。2018年5月,正大天晴安罗替尼经国家药品管理局批准上市,用于既往至少接受过2种系统化疗出现进展或复发的局部晚期或转移性非小细胞肺癌患者的治疗,成为全球首个用于肺癌治疗的抗血管生成药物。
除了单药用于非小细胞肺癌的治疗之外,临床研究显示,抗血管生成小分子靶向药与PD-1/PD-L1单抗具有很好的协同效应,联合使用可进一步延长这类小分子靶向药的生命周期。
肺癌是免疫检查点抑制剂PD-1/PD-L1单抗的重要适应症之一,这类药物最早用于肺癌的二线治疗,海外Checkmate-017、Keynote-010、OAK及中国Checkmate-078等临床研究相继证明了PD-1/PD-L1单抗用于NSCLC二线治疗的临床获益。
从总体上来看,PD-1/PD-L1单抗单药治疗的有效率较低,短期疗效不显著,但患者的长期疗效获益显著。与其他药物联合使用,并寻找合适的生物标记物甄选目标治疗人群、提升疗效是这类药物未来发展的重要方向。
临床试验合作,请咨询18603823910。
转载自新浪医药新闻,*声明:本文由入驻新浪医药新闻作者撰写,观点仅代表作者本人,不代表新浪医药新闻和思途医疗器械CRO立场。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
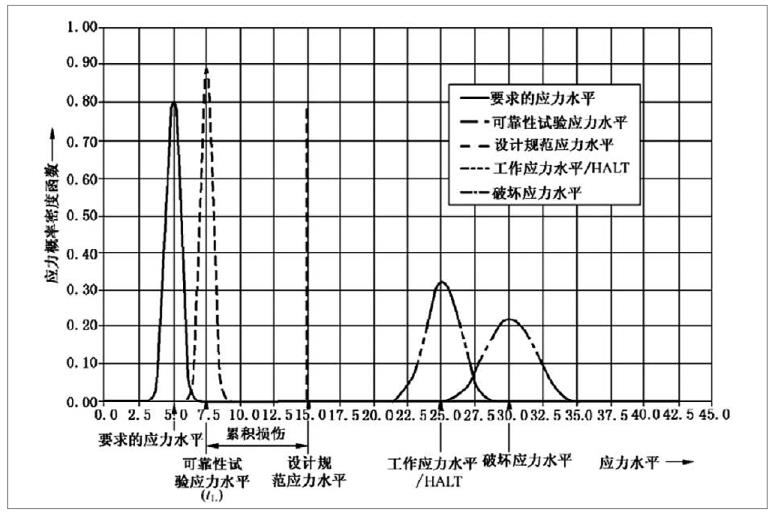
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有

简述了中药新药临床试验主要特点,指出要重视风险、受益评估,重视人 用经验选择科学、客观、合适的有效性指标,做好中医证候疗效评价,鼓励在中药新药临床研究中采用电子化手

近日美国食品药品监督管理局(FDA)更新了《医疗器械提交的反馈申请和会议申请:Q-Submission指导原则》。此文件是对2019版Q-sub指导原则的更新,更新的主要内容如下:1. 增加了STeP医疗

按照中共中央办公厅和国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)和《国务院关于修改〈医疗器械监督管理条例〉的决定》(

体外诊断试剂临床试验数据造假行为,怎么处罚?本文针对体外诊断试剂注册环节的临床试验数据造假行为,一起来看看惩罚力度。

国家药监局器审中心关于发布定性检测体外诊断试剂分析性能评估等6项医疗器械产品注册审查指导原则的通告(2022年第36号) 发布时间:2022-09-28 为进一步规范定性检测体外诊断试剂分析

为进一步规范体外诊断试剂的管理,国家药监局器审中心组织制定了《人类SDC2基因甲基化检测试剂临床试验资料技术审评要点》、《异常凝血酶原测定试剂临床试验资料技术审评要点》
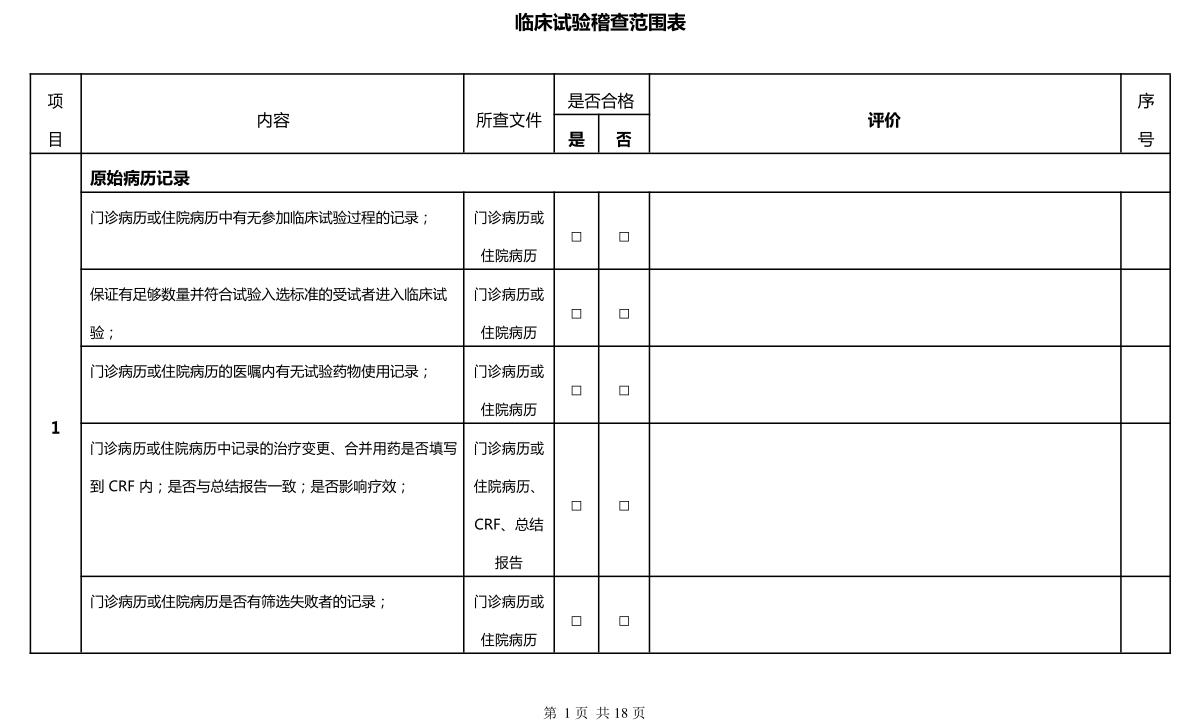
临床试验第三方稽查公司不少,思途就是其中之一。在稽查时,相关人员要明确稽查范围,让临床试验更真实化、合规化。本文将思途在给客户做稽查时的稽查表分享出来,文末供下载

江苏省2021年医疗器械临床试验监督抽查项目 序号 备案号 试验用医疗器械名称 申办者 临床试验机构 1 苏械临备20190008 连续血糖监测系统 南通九诺医疗科技有限公司 南京大学医学院附

随着医疗器械分类及免临床医疗器械目录的调整,部分电子内窥镜产品的管理类别从III调整为II类,同时列入免于进行临床试验的医疗器械目录,因此在注册申报过程中,其注册申报要求
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台