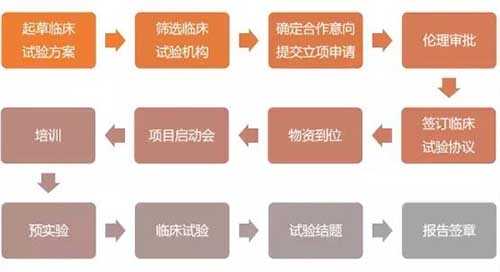
什么是Ⅰ期临床研究?一文搞懂Ⅰ期临床试验全过程
医学的进步是以研究为基础的,这些研究在一定程度上赖于以人作为受试者的试验。--《赫尔辛基宣言》。Ⅰ期临床研究目的是确定可用于临床新药的安全有效剂量与合理给药方案。根据
来源:医疗器械注册代办 发布日期:2025-08-02 阅读量:次
体外诊断试剂(IVD)的性能评估是其注册上市的关键环节,直接关系到临床检测结果的准确性和可靠性。其中,检出限(LoD)和线性范围(Linearity)是两个核心的分析性能指标。检出限关乎试剂能否“看见”目标分析物,线性范围则决定了在多大浓度范围内检测结果能准确反映实际浓度。进行这两项研究时,试剂的生产批次和适用的检测机型是需要重点规划的因素。这涉及到研究设计的科学性、结果的代表性以及最终能否覆盖所有声称的适用场景。下面我们就详细说说批次和机型在这两项研究中的具体考虑要点。

体外诊断试剂的检出限与线性研究并非一蹴而就,通常分为四个明确的阶段:检出限的建立、检出限的验证、线性范围的建立、线性范围的验证。
1.这四个阶段各有目的。建立阶段旨在通过系统实验,初步确定试剂可能的检出限值或线性范围边界。验证阶段则是为了确认在建立阶段确定的性能指标,在预期的使用条件下(如不同批次试剂、不同操作者、不同天数)是否稳定可靠。
2.样本的选择至关重要。首先,用于建立阶段和验证阶段的样本不能重复使用。也就是说,验证阶段需要用独立于建立阶段的新样本进行测试。
3.其次,研究所用的样本需要覆盖试剂声称适用的所有型别(例如,对于病原体检测试剂,需覆盖其声称能检出的所有基因型或血清型),或者至少覆盖主要的、临床常见的型别。 这确保了研究结果能代表试剂在真实世界中对不同变异的目标分析物的检测能力。
当您的体外诊断试剂设计为可在多种仪器设备(即“适用机型”)上运行时,注册申报时需要提供这些机型的详细信息。
1.这包括但不限于:机型的注册证信息(如已有)、其详细的结构组成、关键的性能参数(如温控精度、光路系统性能、加样精度等)、运行该试剂所需的特定反应程序设置参数(如孵育时间、温度、读数波长等),以及最终反应体系的详细构成(样本量、试剂量、总体积等)。
2.特别需要做的是反应体系对比。要清晰地展示不同适用机型在运行该试剂时,其反应体系(特别是样本和试剂的最终加样量比例)是否一致。
3.在这些适用机型中,往往会存在一个或多个“代表性机型”。这个代表性机型的选择并非随意,它必须在工作原理(如化学发光、酶联免疫、PCR等)、核心检测方法、反应条件控制(温控、时控等)、信号采集与处理算法等核心方面,与其他适用机型保持高度一致或基本相同。 代表性机型的性能研究结果,应能合理推断到其他与之“基本相同”的机型上。
基于上述对适用机型和代表性机型的理解,研究批次和机型的组合主要有两种可行的策略:
(1)如果您的产品存在明确的代表性机型(且经论证其核心性能与其他机型基本相同),那么可以选择在代表性机型上,使用3批不同生产批次的试剂产品,完成检出限的建立和线性范围的建立研究。
(2)同时,在这3批试剂的代表性机型上,还需要使用其中1批试剂进行检出限的验证和线性范围的验证研究(注意验证样本需独立于建立样本)。
(3)对于其他适用机型(非代表性机型),则需要进行3批试剂产品的检出限验证和线性范围验证研究。这主要是为了确认在代表性机型上建立的关键性能指标,在其他“基本相同”的机型上同样有效。
(1)如果您选择不在代表性机型上进行核心建立研究,或者出于更全面验证的目的,可以选择在所有适用机型上,都进行3批试剂产品的检出限建立和线性范围建立研究。
(2)同时,在所有这些机型上,还需要使用其中1批试剂进行检出限验证和线性范围验证研究(同样,验证样本独立于建立样本)。
(3)这个策略工作量更大,但数据更直接地证明了每个机型上的性能。
无论采用哪种研究策略,一个核心目标是确保试剂在所有适用机型上展现出的分析性能(特别是检出限和线性)应该是基本一致的。
1.如果在研究过程中发现,某个适用机型(即使被列为代表性机型)在某个特定检测项目上的某项分析性能(比如某个低浓度点的检出能力,或高浓度端的线性表现)与其他机型存在显著差异,那么仅仅进行验证研究可能就不够了。
2.针对这种性能差异,申请人必须针对该差异,采用存在差异的特定机型,进行充分的分析性能建立及验证研究。这可能意味着需要针对该机型/该项目,重新进行更细致的检出限或线性研究,以确定其在该机型上的真实性能边界,并在说明书中清晰说明。不能简单假设代表性机型的结果可以覆盖。
体外诊断试剂检出限与线性研究是确保产品质量和临床有效性的基石,明确分为检出限建立、检出限验证、线性建立、线性验证四个阶段。研究过程中必须使用独立样本,且样本需覆盖所有声称型别或主要型别。申报时,需详尽提交所有适用机型的注册信息、结构组成、仪器性能、反应程序参数及反应体系对比数据;代表性机型的选定需基于其与其他机型在工作原理、检测方法、反应控制及信号处理等核心方面的基本一致性。
在存在代表性机型的前提下,申请人可灵活选择研究策略:或在代表性机型上完成3批建立研究及1批验证研究,同时在其他机型进行3批验证研究;或对所有适用机型均执行3批建立研究及1批验证研究。无论如何选择,核心目标是确保所有适用机型的分析性能基本一致。若发现不同机型对特定项目的某项性能存在差异,必须针对该差异,采用相关机型进行充分的分析性能建立及验证研究。
需要强调的是,以上要求主要适用于常规体外诊断试剂。对于创新产品、采用全新方法学、结构或性能特殊的试剂,或在性能评估中出现的新问题,必须结合申报资料的具体情况进行深入分析,采取针对性的研究方案。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

医学的进步是以研究为基础的,这些研究在一定程度上赖于以人作为受试者的试验。--《赫尔辛基宣言》。Ⅰ期临床研究目的是确定可用于临床新药的安全有效剂量与合理给药方案。根据

我国GCP的附录中也列出了类似必备文件,详细内容读者可以参考这两个规范的附录部分。——《药物临床试验与GCP实用指南》......下面介绍研究者应当保存的重要文件及要求。"

关中心访视(Close Out Visits,简称COV),想必大家都听说过。作为临床试验最后一个阶段,COV也是非常重要的一个环节,今天和大家分享一下作为监查员在COV时应该做哪些工作。什么时候

临床试验机构和研究者是临床试验实施的主体,高质量的试验研究必须依赖于有能力有责任的机构和研究者方能完成,因此,机构和研究者的选择是关乎试验的成败的关键环节之一。选
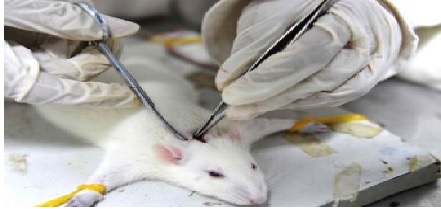
动物实验是大多数高风险医疗器械临床试验前必经项目,帮助评价医疗器械安全有效性,及给医疗器械在受试者进行临床研究提供安全有效性支撑。我们一起来了解一下动物试验要点。

经常有朋友问什么产品无需进行临床试验?小编就在这简单的说一下关于体外诊断试剂注册的免临床和临床评价。如果有什么不对的地方或者漏缺的,麻烦大家多多留言共同探讨!"
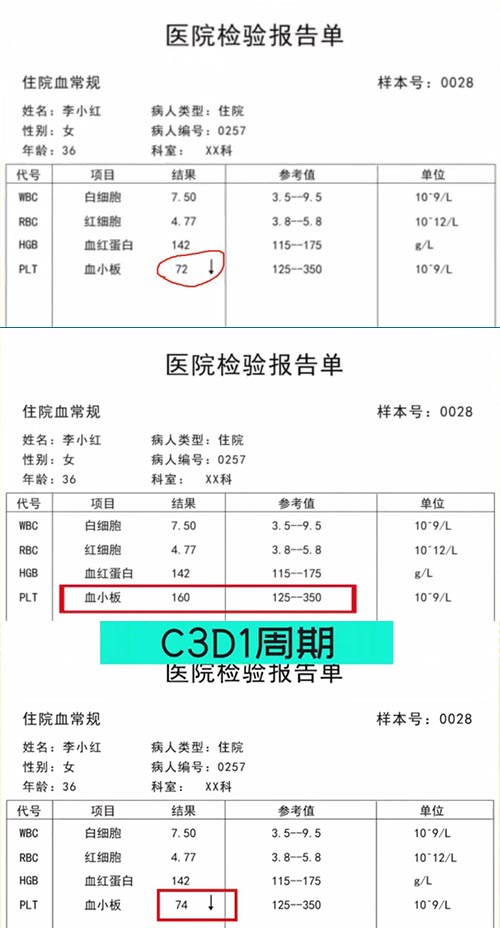
某乳腺癌项目012号受试者,基线期血小板计数降低II级,研究者判断有临床意义,并将血小板计数降低记录在病史之中。C2D15周期用药前实验室检查显示恢复了正常水平,然后在C3D1周期用

中心筛选,是非常关键的一步,好的研究中心和好的研究者,对项目至关重要,就此,提供筛选中心的重点,给大家带来一些参考。 临床试验研究中心怎么筛选?送你20条筛选重点 1、
新冠肺炎疫情发生以来,相关药械企业为满足诊断需求,加速研发生产新冠肺炎诊断产品;特别是作为确诊新冠肺炎的主要产品——体外诊断试剂,国家药监部门对其注册申请启动了应
研究利益冲突政策,第一条 研究的客观性与伦理审查的公正性是科学研究的本质和公众信任的基石。临床研究的利益冲突可能会危及科学研究的客观性与伦理审杳的公正性,并可能危及
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台