体外诊断试剂IVD的贮存条件和运输要求
在我国,体外诊断试剂(IVD)是指:可单独使用或与仪器、器具、设备或系统组合使用, 在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中, 用于对人体样
来源:医疗器械注册代办 发布日期:2025-01-02 阅读量:次
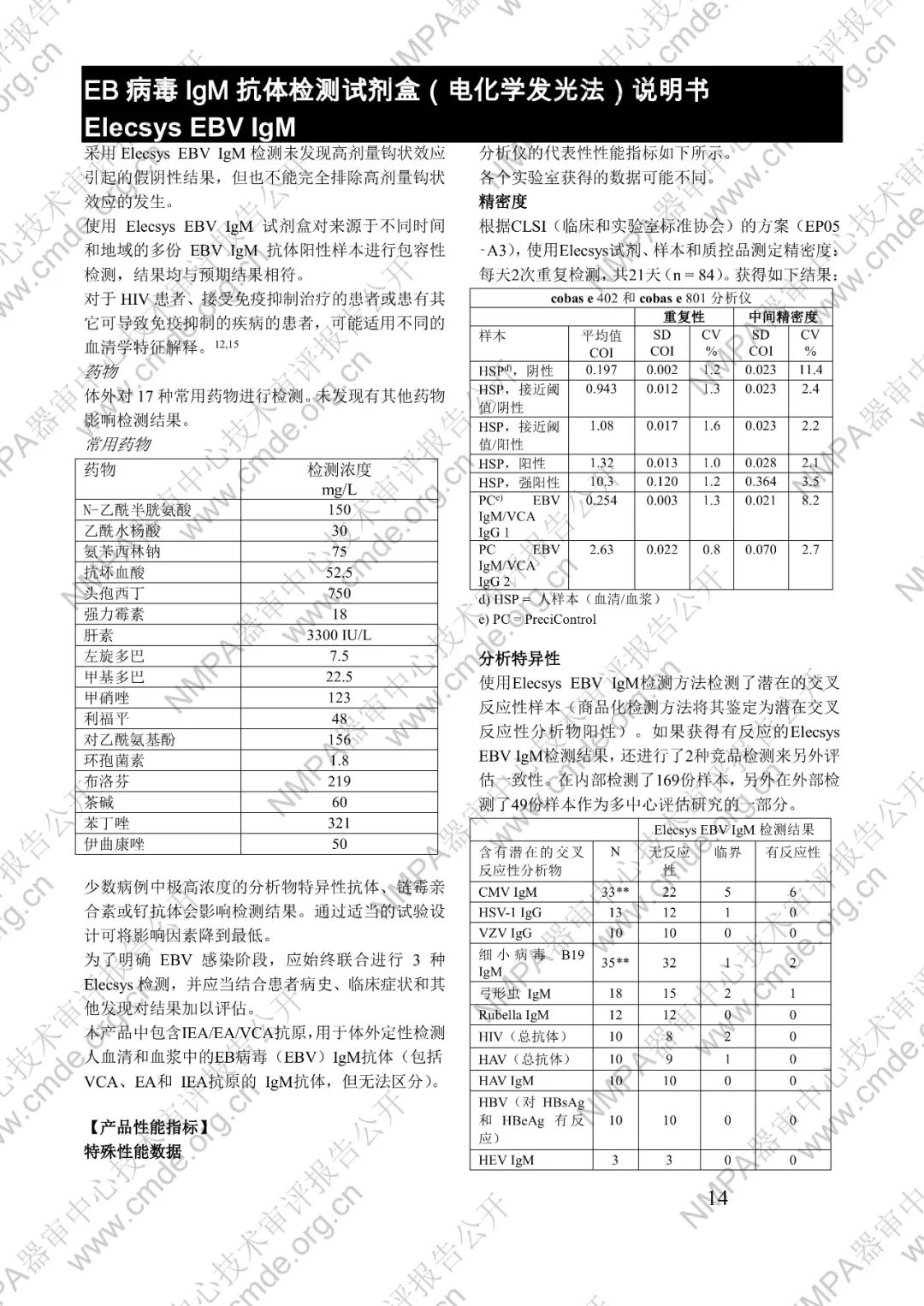
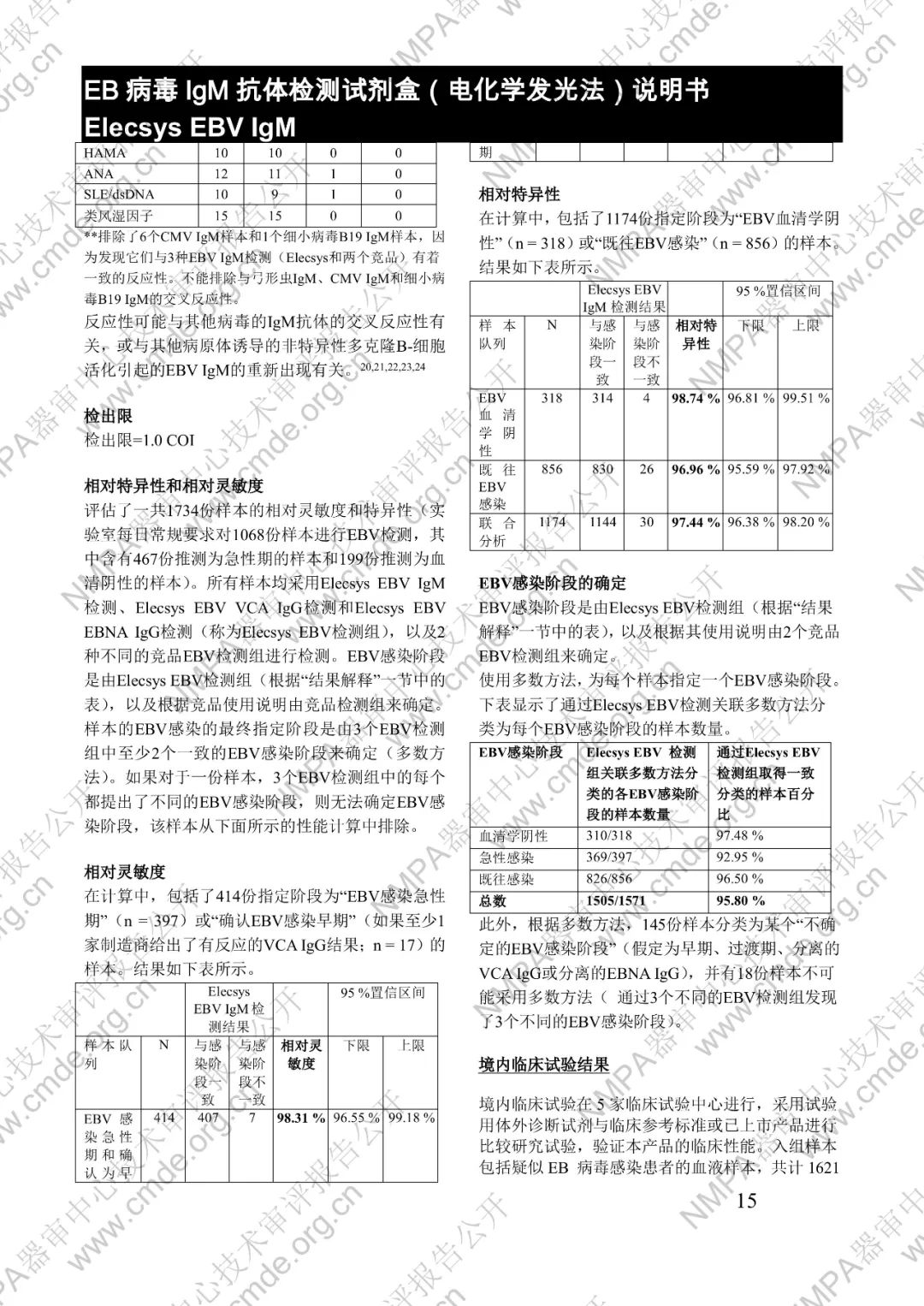
国家药品监督管理局医疗器械技术审评中心于2024年12月10日公开《EB病毒IgM抗体检测试剂盒(电化学发光法)》产品注册技术审评报告。申请人:罗氏诊断公司 Roche Diagnostics GmbH。
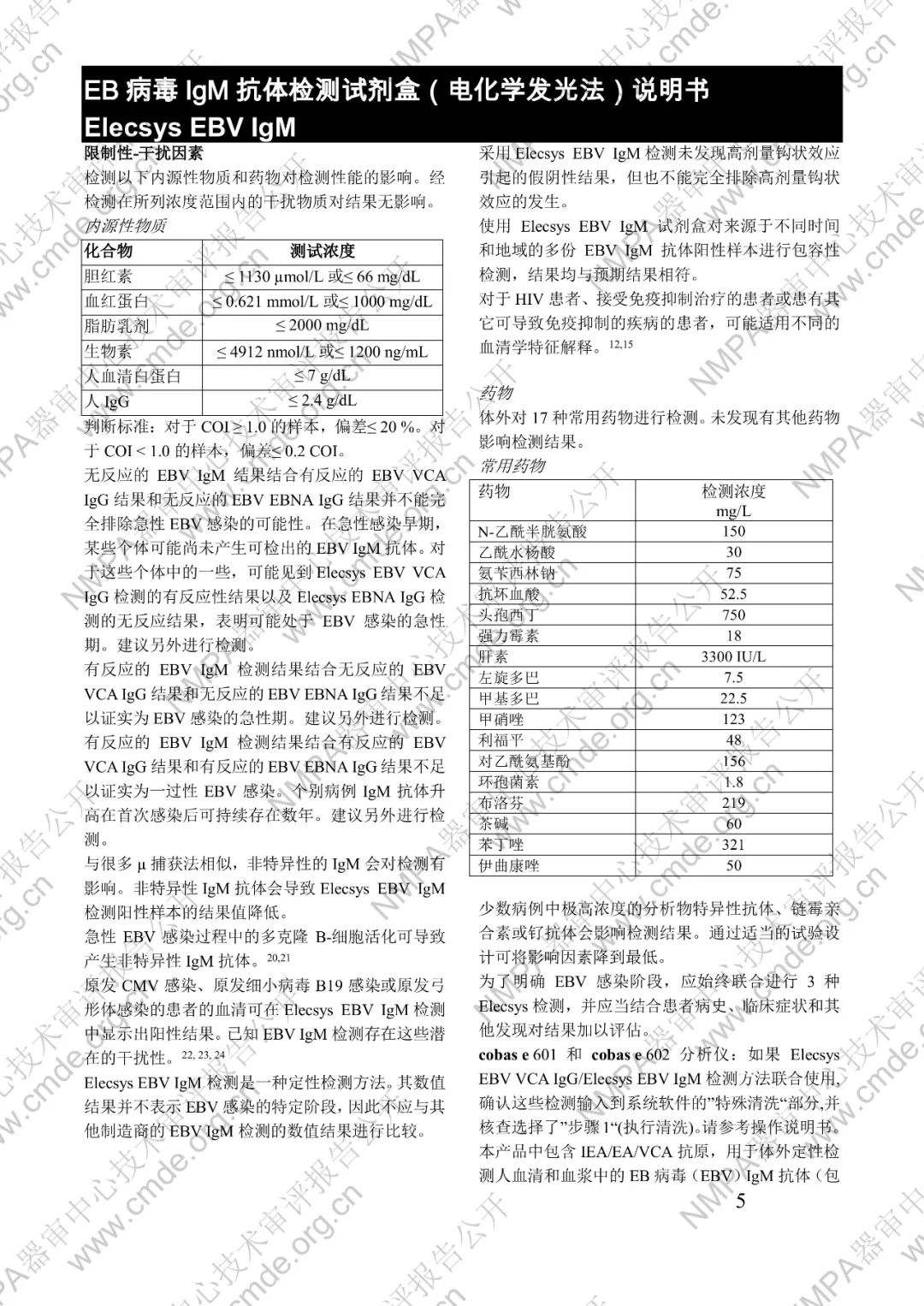
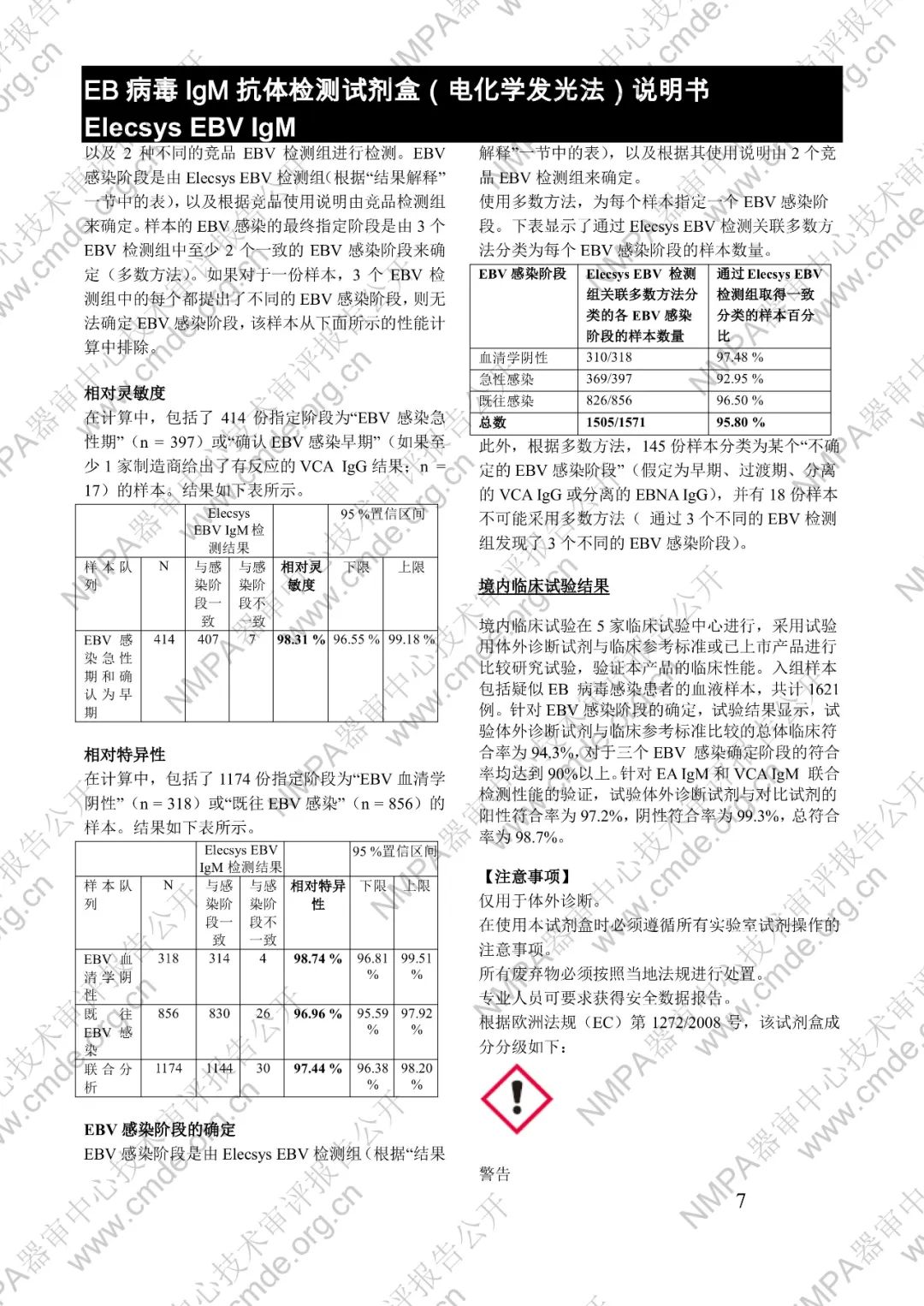
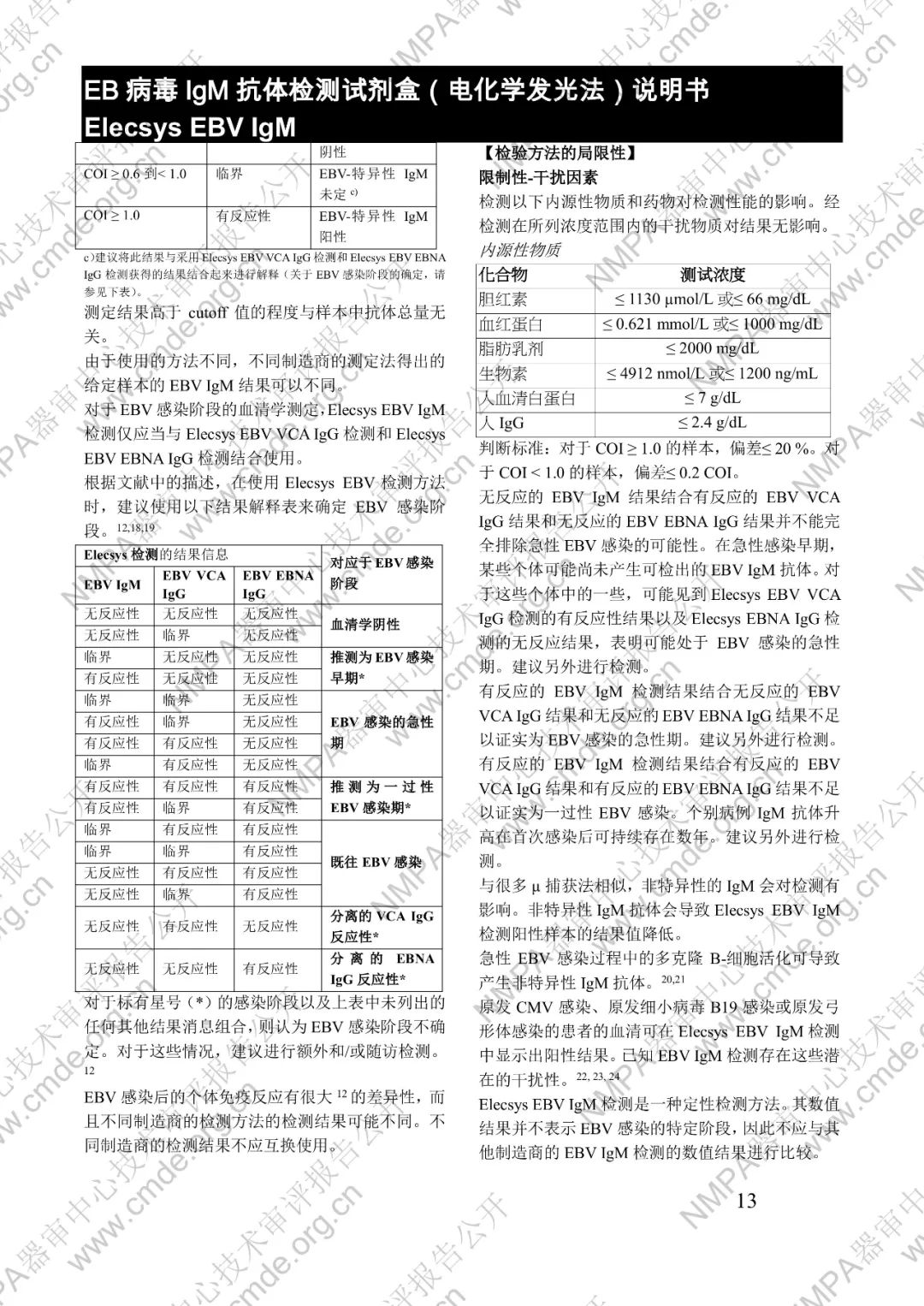
本产品用于体外定性检测人血清和血浆中的 EB 病毒(EBV)IgM 抗体(包括 VCA、EA 和 IEA 抗原的 IgM 抗体,但无法区分)。本产品用于辅助诊断传染性单核细胞增多症和判定 EBV 感染阶段。
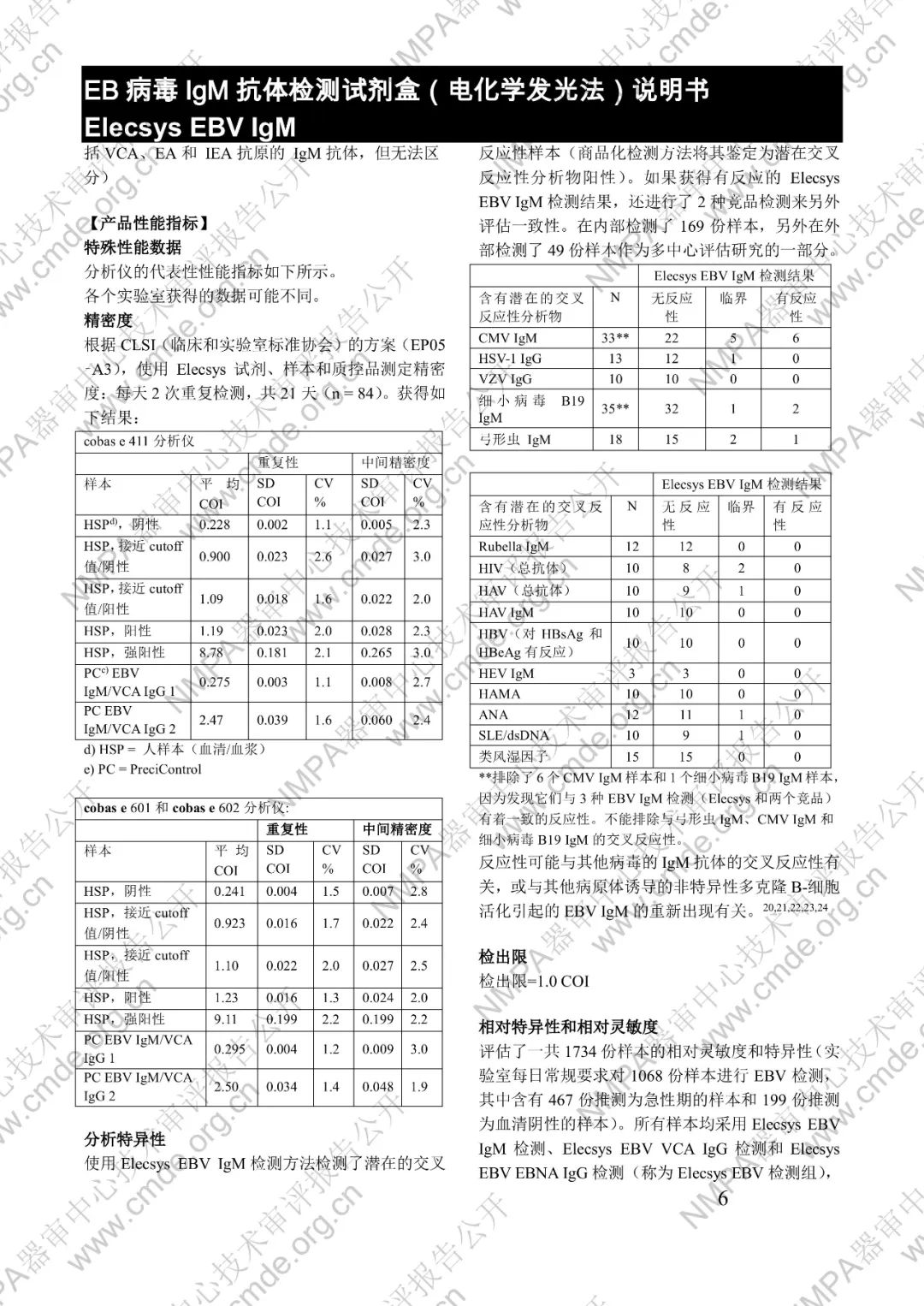
μ-捕获原理。总检测时间:18 分钟。第 1 次孵育:使用样本稀释液自动稀释样本。加入生物素化的 anti-h-IgM 特异性单克隆抗体片段。第 2 次孵育:加入钌复合物标记的 EBV 特异性重组抗原和包被链霉亲合素的微粒。该复合物在生物素和链霉亲合素的相互作用下结合到固相载体上。将反应液吸入测量池中,通过电磁作用将微粒吸附在电极表面。除去未与微粒结合物质。给电极加以一定的电压,使复合物化学发光,并通过光电倍增器测量发光强度。仪器通过软件(比较由样本反应产物获得的电化学发光信号值和先前定标获得的 cutoff 值)自动计算检测结果。
























来源:NMPA

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

在我国,体外诊断试剂(IVD)是指:可单独使用或与仪器、器具、设备或系统组合使用, 在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中, 用于对人体样

为进一步规范体外诊断试剂的管理,国家药监局器审中心组织制定了《人类SDC2基因甲基化检测试剂临床试验资料技术审评要点》、《异常凝血酶原测定试剂临床试验资料技术审评要点》
体外诊断(In Vitro Diagnosis,下称IVD),是在人体之外,通过对人体样本(血液、体液、组织等)进行检测而获取临床诊断信息,进而判断疾病或机体功能的产品和服务。IVD已经成为人类

2016年起,医疗机构对有冷链要求的体外诊断试剂实施了入库验收制度,要求供应商按照医院规定的时间将产品送到科室,必须由试剂管理部门验收人员、科室人员双方一起验收,验收要

为落实《医疗器械监督管理条例》(国务院令第739号)要求,根据《医疗器械注册与备案管理办法》(市场监管总局令第47号)《体外诊断试剂注册与备案管理办法》(市场监管总局令第48号),

2020年11月9日,广东省药品监督管理局发布《关于调整广东省医疗器械注册审评补充资料预审服务的通告》,详见正文。"

对于企业而言,增长是永远的命题。无论过去赚了多少亿,每一年的开始,又会是一个新问题。

近期,申请医用口罩、防护服、额温计等应急第二类医疗器械注册证的企业和客户较多,因此,带大家一起来回顾一下2019年下半年浙江省药监局发布的有关生物学和EMC检测方面的官方解
10月19日,上海药监局发布创新医疗器械审评审批问题答疑,对常见的5个关于创新医疗器械问题进行解答。如果你有创新医疗器械注册需求,那一定要看。"

近日,湖南省药品监督管理局发布公告,决定对第二、三类医疗器械生产许可行政审批事项实行全程无纸化网上办理,即实现第二、三类医疗器械生产许可“网上申报、网上受理、网上
行业资讯
知识分享
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台
