体外诊断试剂IVD的贮存条件和运输要求
在我国,体外诊断试剂(IVD)是指:可单独使用或与仪器、器具、设备或系统组合使用, 在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中, 用于对人体样
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
对于企业而言,增长是永远的命题。
无论过去赚了多少亿,每一年的开始,又会是一个新问题。

从去年湖北核酸试剂集采开始,试剂价格一路走低,从十几块,最低到了5块多。有人测算出核酸试剂盒每份平均生产成本约在3元-5元左右。虽然利润不高,但是用量大。近2年不少城市出现散发疫情,都采取了多轮的全员筛查,加之国家采取动态清零的严格防疫政策,整体对试剂的消耗很大。不少IVD企业在年报中都表示试剂价格普遍下调,对营收有一定影响,但今年发货总量增加了。
试剂价格很便宜,检测收费也下降了。目前不少官方指导价核酸的单管检测最低25元,混检8元。对于做第三方检测的企业来讲,也要靠薄利多销。有负责人称,医检所每天至少五百多例以上才能达到盈亏平衡点。
出口海外的抗原试剂价格同样很低,多家企业表示出口欧洲1人份不到1美元,都希望能把产能提升,接的单够大才能赚一点钱。
2022年,这种情况必然会更加普遍。
新冠的机会看似很多,核酸、抗体、抗原、检测服务、原材料、检测耗材都能挣到钱,但没有哪一家是能够通吃的。
IVD企业只能挣到自己能力范围内的钱,核酸营收大增的企业一直都是深耕分子领域的,比如达安、圣湘、之江;卖抗原出海的黑马企业,也都是做POCT起家,并且在海外深耕多年的,如东方、热景、万孚、宝太;第三方检测做到最大的,依然还是金域、达安、华大这些企业。
IVD企业的焦虑或许是来自一种盲目all in,任何一个新冠业务的爆发,都认为是自己没有抓住机会,其实是自己根本没有能力。做业务不是押宝,这个时候,只要追随着,顺便挣一些就可以了。以前没做过传染病业务的企业没能够第一时间抓住新冠的机遇,但是后面自己慢慢模仿着做也会有不错的市场机会。
所以,踏踏实实做自己的主业,只挣属于自己的钱,才不会焦虑的睡不着觉。
但凡是有一定技术含量的产品,一定是经过了长时间的技术积淀的。无论是分子还是发光,不要妄图自己能很快研发出一款好产品快速上市。有产品需求焦虑的企业最好不要自己研发,直接去OEM和收购可能更划算,他们一定比你自己研发的还要好。当前,效率才是最重要的。看看这一年的变化,很多外企都在代理中国本土产品了,这是趋势。
自己建渠道也不如找合作伙伴共同成长。就拿核酸试剂来说,拿下证的有30多家,但却不是每一家都能够业绩好,还是有不少业绩不行的。一证价值千金,如果能够早点和有实力的企业合作,能收获到的远不止现在。前几天看到,浩欧博的自免发光产品都能够适配迈瑞的发光仪了,一切合作皆有可能。
敞开心扉,兼并合作,可能会少很多焦虑。
中国的IVD市场目前不是你是我活的竞争格局,而是合作共赢的局面。
以前不在IVD视野范围的九安医疗,拿到了美国新冠抗原自测的紧急授权,马上就成了香饽饽,股票涨了好几倍,业绩也能够翻好几番。艾康生物也获得同样的殊荣,可以几亿人份的卖给美国市场,并且价格不菲。而其他IVD企业只能干看着,没证卖不了。
国内的NMPA证同样稀缺,刚开始拿到新冠试剂证书的都成了市场的宠儿,如之江、华大、圣湘、伯杰、捷诺、万孚、明德、英诺特等等。
而欧洲市场,先拿CE证的同样捷足先登。热景、东方、宝太都风光一时。
所以,多重视注册部门吧,把注册建立在火线上。
这两年,IVD挺缺人的,注册、国际销售、市场准入、研发、质量、生产的人都缺。企业更应该主动培养人才,创造适宜环境。而不是挖来挖去的做博弈游戏,结果只会是付出更多的薪金,平添浮躁和焦虑。企业固有的人才体系才是基本盘,应该整体提升待遇水平,而不是拉高高管的待遇,提升被平均的水平。
很多的企业只顾着把人挖过来干活,对于人才培养和成长往往是忽略的,不然只会面临人才流失的焦虑。
安徽集采的刀已经砍下来了,他带来的舆论恐慌远大于实际执行的影响。归根结底的影响,就是带来了降价。但IVD确实不同于药品和高值耗材的产品属性,医保其实降检验收费就可以压缩后端了,所以还是具有一定的特殊性。看来,各地阳光挂网的政策应该有一个较长的执行期,而大面积集采复制恐怕比较难。
但企业确实应该重新梳理自己的产业链了,如何实现成本领先,是一个需要焦虑的问题。
该考虑共同富裕了
先知先觉的一哥迈瑞已经在路上了,IVD企业一个都少不了的。IVD行业本质上是建立在社会公共服务医疗的基础上的,不仅需要在医疗技术创新上帮助社会解决问题,也需要在先富的道路上,再通过经济上回馈社会。
简单讲,年报的社会责任一栏,以后需要更加的重视。社会援助、家乡建设、研产共创、支持政府、引进国资都需要有所行动,这是企业大而不倒的金玉良律。
焦虑是前进的动力,2022年,IVD领域的发展一定会更精彩。
来源:张洪华品牌管理


站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

在我国,体外诊断试剂(IVD)是指:可单独使用或与仪器、器具、设备或系统组合使用, 在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中, 用于对人体样

医疗器械注册费是行政性收费,按照注册单元收取,部分省份不收取医疗器械注册费用,绝大部分省份还是收取的。本篇文章统计了截止到2022年1月5日各地医疗器械注册收费标准。
体外诊断(In Vitro Diagnosis,下称IVD),是在人体之外,通过对人体样本(血液、体液、组织等)进行检测而获取临床诊断信息,进而判断疾病或机体功能的产品和服务。IVD已经成为人类

药品/化妆品/医疗器械企业卖假货无证销售罚多少钱?近期福建省发布药品医疗器械化妆品卖假货无证销售典型案例,一起来看看惩罚力度和罚款额度。"

为进一步规范体外诊断试剂的管理,国家药监局器审中心组织制定了《人类SDC2基因甲基化检测试剂临床试验资料技术审评要点》、《异常凝血酶原测定试剂临床试验资料技术审评要点》

2016年起,医疗机构对有冷链要求的体外诊断试剂实施了入库验收制度,要求供应商按照医院规定的时间将产品送到科室,必须由试剂管理部门验收人员、科室人员双方一起验收,验收要
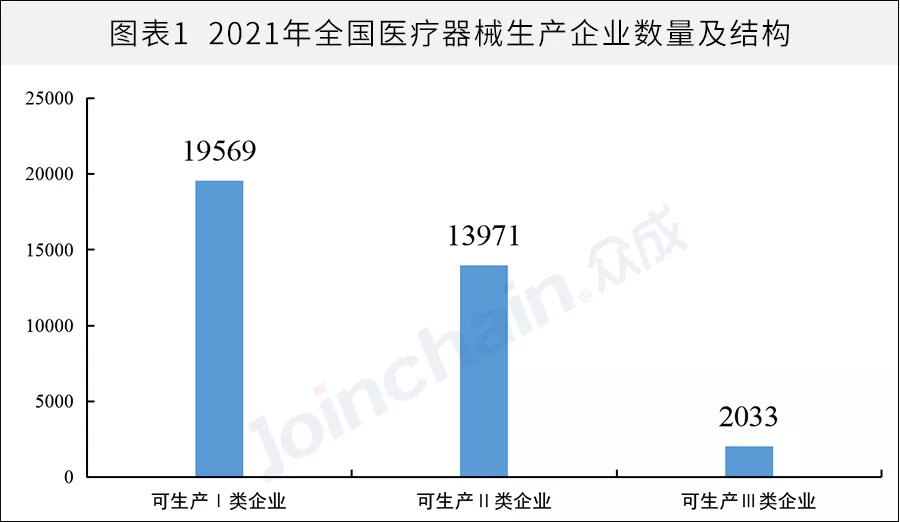
据众成数科统计,截至2021年12月31日,全国医疗器械生产企业数量达28954家,较2020年的25440家同比增长13.8%。其中,可生产Ⅰ类产品企业19569家,可生产Ⅱ类产品13971家,可生产Ⅲ类产品

国家药监局器审中心关于发布定性检测体外诊断试剂分析性能评估等6项医疗器械产品注册审查指导原则的通告(2022年第36号) 发布时间:2022-09-28 为进一步规范定性检测体外诊断试剂分析
糖尿病是重要的医疗领域之一,目前我国糖尿病医疗费用的市场规模约6000亿元,占中国政府医疗预算的8%。因此政府在制定"健康中国2030"战略时,特将糖尿病等慢性病作为全民医疗的核

为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了《一次性使用高压造影注射器及附件产品注册审查指导原则》《金属接骨板内固
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台