临床试验中的单盲、双盲、三盲、破盲是什么意思?
盲法试验常用的有两种:单盲(single blinding)和双盲(double blinding),更严格的对照试验要用到三盲(triple blinding),在对照药物和试验药物剂型或外观不同时,还要用到双盲双模拟技
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
2022年转眼来到了第三个月,对于临研行业的从业者来说,如何更加高效率、高质量、高要求地完成项目的各项操作及任务体现了更多的挑战,在一定程度上决定了今年自己是否能完成既定的目标,同时更上一层楼。笔者结合个人的行业经验,撰写了此篇内容,希望能对大家有所帮助。
①首先,最重要的:务必非常熟悉自己所负责项目的方案,尤其是入排标准和用药,一般可以通过方案摘要了解本项目整体情况;方案一般有流程图,要注意核对流程图上每一个小细节,尤其是流程图后面的备注部分,一般申办方也会根据此流程图做一些流程图的小文件,可以在实际执行的时候,对每一个节点进行逐一核对。已完成的及时标注,未完成或待确认的一定要及时做好备注,每个预筛患者都独立弄一份,一直持续到研究完成。若申办方未提供,CRC可根据项目情况自制,然后同CRA进行核对。
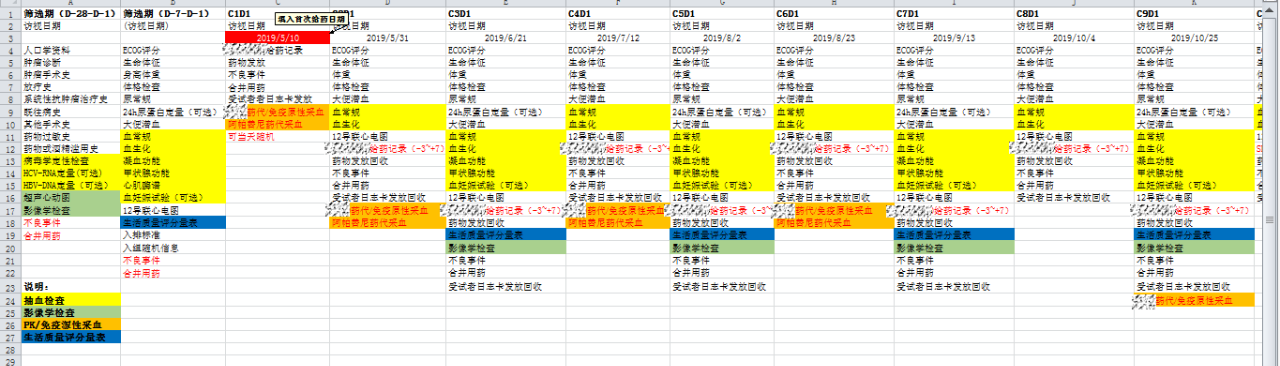
②在熟悉方案和项目相关规定的前提下,进行筛查患者,若初步合适可签署知情同意书,签完后务必告知患者自签署起有哪些药物是绝对禁忌的,需撰写知情过程,过程也需体现患者询问的具体问题;进入筛选期后,注意安排好患者和研究者的时间,如下图筛选期内需收集的相关资料清晰明了,只需对照上图中每一个细节进行收集,可简单汇总患者既往治疗情况和筛选期检查于CRA或申办方医学部进行审核,确保不误入违背入排的患者。同时注意安排好筛选期检查,注意时间窗,一般病史类资料收集时间为0-28d,检查在0-7天之内。
③筛选期内符合要求的,进行随机分配,此次应注意分配到不同组别或队列随访的要求会不一致,随访期内需做的检查可以参考流程图进行逐一核对,每次用药前先仔细核查此次随访每一项检查是否全部完成,涉及到有受试者日志卡的,需确认受试者是否按时记录服药信息,查看是否有错服、漏服情况。研究者要确认受试者是否达到并符合继续用药要求;尤其是发生AE事件2-4级时是否需要停药,若方案要求2级应延迟用药,而研究者认为2级影响不大,需出具正式的邮件于申办方确认,同时对方案中描述模糊(界定不明)的地方,也应及时跟申办方医学或CRA确认。
④符合用药的基础上,注意仔细核算所有涉及药物的剂量,包括配液,核算的药物剂量务必同研究者、CRA进行一一核对,保证没有任何错误。研究者开具的医嘱或处方要再三进行核对。对于注射用药,研究护士配制药品时需要CRC全程协助和监督,避免错配、多配、漏配等情况,CRC要明确告知研究护士具体的配制操作及溶度要求,及协助研究护士观测患者输液期间是否有不良反应。对于口服药物,注意同种药物的规格,如250mg的阿帕、375mg的阿帕存放地点、位置一致时,应注意区分。发放患者时需再次核对,并明确告知正确的服用方法和记录方法。
值得注意的是:对于患者若漏服或者不慎将当日药物丢失或掉落在地污染是否可以直接继续取新药服用,需要看方案要求,若要求任何情况下不允许患者私自服用,则可能导致方案违背。
⑤涉及除常规安全性检查外,还需PK采血、免疫原性采血的患者,应注意实验室手册规定的各样本取样的时间节点,如给药前和给药后30min内,及取样后静置的时间轴、及离心的转速、时长,转运和分离的时长,如1210需给药前30min内采集一次PK和免疫原性采血,需静置0.5-1h,在1-2h内完成采样、离心、转运、分离;阿帕需给药前30min内和给药后4h内采集一次Pk采血,无需静置,但需在1h内完成采样、离心、转运和分离。因此,对于方案中的细节要求要非常熟悉,而且要掌握好研究护士的时间,如某患者12:00计划服药,不宜早于11:30前找研究护士采样,也不宜11:50后才找护士采样,两者时间都易造成方案偏离。(建议:采用时间倒退法)
⑥违禁用药和AE事件未及时处理导致方案违背或偏离:如某肿瘤患者体重下降基线期65kg,后续随访某周期41Kg,按方案要求需暂停用药,但由于CRC平时按照常规思维只注重有没有测量体重这个单纯的数据,而忽视了体重下降达到某个百分比是个AE事件,就可能导致方案违背。
如患者8.6发生了严重截瘫,有大面积溃疡面,需要立即停药处理,但由于CRC发现不及时,或较迟联系患者,导致未能及时停药而造成更大的后果,也导致了方案违背。如某肿瘤患者药物性肝损于外院行护肝治疗,由于当地医院医生不清楚患者具体的违禁用药,及CRC同患者表述不清或未告知患者,导致患者在外院护肝治疗时服用了违禁抗肿瘤用药,导致重大方案违背。偏离大部分是CRC经验缺乏或责任心不够,导致某些指标未在规定时间内完成。
⑦时间窗计算:由于CRC对时间窗的理解有误或计算错误,或忘记了某患者的随访时间,或在随访时间将近时未及时提醒患者,或在规定的时间窗内漏查了某项检查,都易造成方案违背或偏离。
如某项目规定患者以每三周为一个用药周期,即21天,若该患者首次用药为2019.1.3,则下周期窗口期应为2019.1.24±3d,许多CRC却核算成2019.1.24±3d,易直接跳过2019.1.3首次用药的时间或其他随访用药当天日期。
因此,CRC需加强对时间窗的理解,最好能提前将下周涉及患者需要进行随访的患者排出来,包括安全性随访和生存期随访的患者,如“11002患者XXX,C6周期:2019.8.21±3d,需提前预约C7周期影像,本周期需加查心功能常规”,即每个患者都需提前做好随访计划及安排,并将计划及安排发CRA审核确认。并提前一周告知患者需何时准时来中心报到,需携带相关资料,并在预约时间前一天再次提醒患者来院行随访。患者来院后,仔细核对流程图上的每一个节点,确保所有的检查全部完成。
⑧SAE上报:由于CRC对SAE的整体认识不足,导致发生了SAE漏报或未能及时上报,或未能在规定的24h内进行上报。SAE一般有个整体的概念,共性情况下需报SAE,但部分情况下,某些方案有规定特殊情况下是可以不用报的,如患者住院是为了报销、或者行常规治疗或其他社会原因。但部分申办方规定既符合SAE又符合重要医学事件的,既需要上报SAE,又需上报SIE,因此,具体的上报形式需按照方案的具体规定。
CRC应经常和患者保持联系,而不是只有在随访期间才联系患者,随访结束后也应明确告知患者有任何不适之症及其他治疗方面务必告知自己,包括任何的用药,必须等CRC确认可以服用后才可以使用。同时需熟知SAE上报流程,一般得提前了解所做项目中心对SAE上报的要求,至少知道完整的一套SAE报告需要哪些资料。如省肿瘤一份完整的SAE包括:递交信、机构受理审批表、SAE报告表(表上写清楚预期or非预期),省局回执,国家局传真失败回执及邮件及对方收到回执,卫健委传真失败回执及邮件及对方收到回执,申办方安全部门邮件,伦理邮件(非正常工作时间段内)。其他中心应以所在中心要求为准,并及时上报,避免未能在规定时间24h内上报完成。
⑨肿瘤影像:肿瘤项目最重要的是要经过影像进行评估,看患者的治疗程度,因此需要特别重视。首先,在筛选期,需要收集患者所有的影像资料,包括骨扫描和PET-CT,也包括在外院既往行的影像,在患者目前所拥有并确定在本项目窗口期内可以使用的影像资料情况下,同时根据方案规定需做的影像部位,同研究者核实患者需要加做或重做的影像检查。
由于后期PD(疾病进展)的患者需要终止研究,因此,在基线期要确保所有的可疑病灶都进行扫描,影像老师可进行评估为靶病灶或非靶病灶。避免基线期漏查某部位病灶,而后期随访发现时,该病灶成为新发病灶,导致患者疾病进展,进而需要终止治疗。然后影像资料及时拷贝、上传和刻盘,一般建议影像报告出具当日即完成影像评估,可提前预约,评估时CRC需全程关注影像老师评估的节点,避免漏评情况。
⑩目前CTCAE分级主要有两个版本,一个CTCAE4.03版本,一个CTCAE5.0版本,肿瘤项目应用较多,具体使用哪个版本要按照方案要求来,有些方案明确规定按CTCAE4.03版本,有些明确CTCAE5.0版本。但需要注意的是,算级别的时候,应根据实际提供的检查单来算,如本院常规ALT:90.2,正常值范围为0-40U/L,4.03版规定超过3.0-5.0倍正常值上限记为2级,即本院为1级;如某外院ALT:90.2,正常值范围为10-30U/L,即外院为2级。CTCAE5.0版本的要注意患者基线期值的水平,会有两个不同标准,一个是基线期正常的情况下分级,一个基线期异常的情况下进行分级。
以上是个人一些建议,真正在执行项目的过程中我们会遇到各种各样的问题,大小不一,而如何在项目前期、项目中期及项目后期管理好项目,尽最大化的保质保量,需要我们所有从业人员的共同努力和不断探索,而不断地深入学习是最有效的捷径,愿我们的每一份付出都有结果。
作者:汤朵

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

盲法试验常用的有两种:单盲(single blinding)和双盲(double blinding),更严格的对照试验要用到三盲(triple blinding),在对照药物和试验药物剂型或外观不同时,还要用到双盲双模拟技

刚接触CRO行业的小伙伴,在学习文件法规资料的同时,常看到一些英文类专业名词不知道是什么意思。下面,一起看看常见的临床试验专业术语: CRO行业的常用术语解释: 1:新药研发

医学的进步是以研究为基础的,这些研究在一定程度上赖于以人作为受试者的试验。--《赫尔辛基宣言》。Ⅰ期临床研究目的是确定可用于临床新药的安全有效剂量与合理给药方案。根据

SSU是Study Start Up的缩写,从最初的项目准备,到启动访视(Site Initiation Visit)之前所有的准备工作,对整个临床研究项目的启动非常关键。负责这个关键阶段工作的部门人员,就叫做SS

不知道你是否有这样的经历,去医院看病,医生开药写的都是服药中文说明。但药物临床试验相反,有些研究者喜欢写医嘱缩写,比如pc,我第一次看到就不知道什么意思,作为一个好奇
试验用药品是指用于临床试验的试验药物、对照药品。试验用药品渗透到了临床试验过程中的每一个步骤,包括药物的生产、包装、运输、保存、使用、回收等。今天我们从临床试验中

在临床试验中,无论是监查员、质控人员或者项目管理人员到研究中心查看项目资料的时候,总会多多少少发现一些问题,有些问题可能大家都比较熟知,但处理手法五花八门的。处理

刚接触医疗器械CRO行业的小伙伴,在学习文件法规资料的同时,常看到一些英文类专业名词不知道是什么意思。下面,一起看看常见的医疗器械临床试验专业术语......"

不少二三类需要临床的产品,客户一听到临床报价就退缩。既然这么贵,还不如自己做......事实真的是这样吗?临床报价费用都由哪些组成?费用都谁收走了?自己做又有哪些风险?文

临床研究协调员(全称Clinical Research Coordinator,简称CRC):指经主要研究者授权,在临床试验中协助研究者进行非医学性的相关事务性工作,是临床试验的参与者。 临床试验现场管理组
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台