有源医疗器械加速老化试验效期验证及使用期限验证流程
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有
来源:医疗器械注册代办 发布日期:2025-07-21 阅读量:次
2025年7月20日,上海市药品监督管理局正式印发《上海市第二类创新医疗器械特别审查程序》(沪药监规〔2025〕4号),为具有显著临床价值的本土创新医疗器械开通"快车道"。该程序自2025年9月1日起实施,有效期至2030年8月31日,旨在加速安全有效的创新产品上市,惠及患者并推动上海生物医药产业高质量发展。
上海此次推出的特别审查程序,精准锁定了真正具有突破性价值的第二类医疗器械。要获得这条"快车道"的通行证,产品必须满足三大核心条件之一:
1.国内首创+性能飞跃:产品核心工作原理或机理属国内首创,性能或安全性相比同类产品有根本性提升,技术国内领先且临床价值显著;
2.专利硬实力:申请人需在中国依法拥有产品核心技术的发明专利权(或5年内合法受让的专利权/使用权),或核心专利已公开且经官方检索确认具备新颖性和创造性;
3.填补上海空白:产品技术国内领先,能填补上海市该品种医疗器械的市场空白。
该程序的核心在于“优先”和“加速”,覆盖产品上市前的关键环节:
1.专人提前介入:在产品注册申请前及审评过程中,上海药监局将指定专人提供全程指导,尤其在临床评价、性能验证、体系核查等关键节点加强沟通,提前解决问题。
2.检验检测提速:上海市医疗器械检验研究院将对创新产品优先安排检验,加强技术指导,优先出具检验报告。
3.审评审批极速:注册申请享受“四优先”——优先受理、优先技术审评(时限压缩至20个工作日)、优先安排体系核查、优先行政审批(时限压缩至5个工作日)。相较于常规程序,审评审批环节时限大幅缩短。
为确保公平公正和审查质量,程序设立了规范的流程:
1.线上申请:申请人需通过“一网通办”平台提交《第二类创新医疗器械特别审查申请表》及相关证明材料。
2.形式审查(5个工作日):创新审查服务办公室(设于上海市医疗器械化妆品审评核查中心)在5个工作日内完成申请资料的形式审查。
3.专家把关:对符合条件的申请,组织专家通过会审或函审进行实质性审查。对资料虚假、矛盾或知识产权不明晰等情况,可不组织专家审直接处理。
4.公示与异议(≥10个工作日):拟同意纳入特别审查的项目将在上海药监局官网公示至少10个工作日,接受公众异议。异议需提交书面理由。
| 项目 | 填写内容 |
|---|---|
| 产品名称 | |
| 申请人名称 | |
| 主要工作原理/作用机理 | |
| 适用范围/预期用途 | |
| 创新点及临床价值简述 | |
| 联系人信息 | (姓名、电话、地址、邮箱等) |
创新审查并非“一劳永逸”。程序规定,审查结果告知后5年内未申报注册的,将不再享受特别审查。若在研发过程中发生重大变更(如临床试验方案、预期用途、核心机理等实质性修改),需重新申请。此外,出现以下情况之一,上海药监局将终止程序:
1.申请人主动要求终止或未履行义务;
2.提供虚假或伪造资料;
3.核心专利申请被驳回/撤回或丧失专利权/使用权;
4.产品经认定不属于第二类医疗器械管理;
5.经专家审查确认不宜继续按本程序管理。
纳入特别程序的产品注册申请人(持有人)需依法承担起产品上市后的不良事件监测和再评价主体责任,确保产品全生命周期的安全有效。
上海作为中国生物医药产业高地,此次出台针对第二类创新医疗器械的特别审查程序,是对国家鼓励医疗器械创新政策的积极响应和具体落实。通过建立“提前介入、一企一策、研审联动、全程指导”的工作机制,在严守安全有效底线的前提下,大幅压缩优质创新产品的上市时间成本。这将显著增强本地企业的创新动力和成果转化效率,助力解决临床急需,最终惠及广大患者,同时也进一步巩固上海在全国医疗器械创新领域的领先地位。像此前通过市级通道加速上市的联影医疗“uEXPLORER探索者”全景动态PET-CT,其临床验证周期较常规路径缩短近7个月,更快服务于肿瘤精准诊疗。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
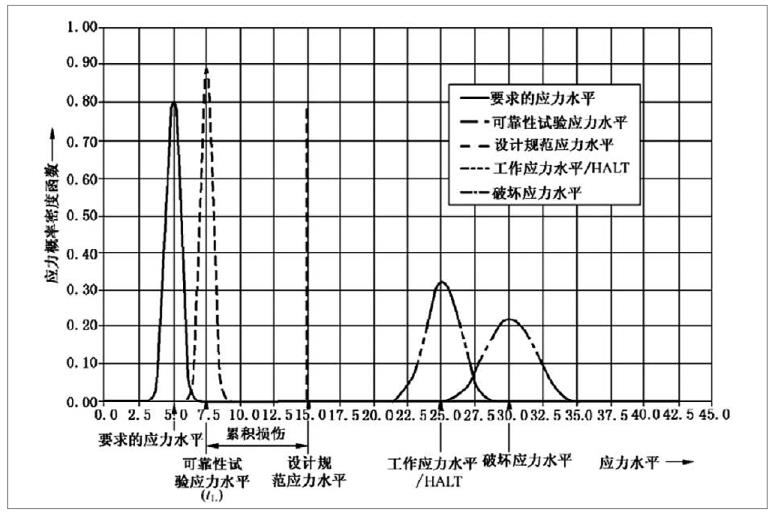
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有

润滑剂类产品在美国根据产品预期用途的不同主要分为人体润滑剂和患者润滑剂:其中,人体润滑剂主要成分为水、丙二醇、羟乙基纤维素、苯甲酸、卡波姆、氢氧化钠等,作用于生殖

中国能排进世界十大医疗器械制造强国吗?暂时还不能,因为排进前十的国家都有许多知名械企和世界级医疗器械巨头;而中国比较出名的可能只有迈瑞了,其他械企仍需努力了。下面

本文介绍了欧盟医疗器械新法规MDR相比于将替代的MDD法规的几点新增要求。建议收藏学习。明年5月份起,Medical Devices Regulation(MDR)(2017/745/ EU)将替代原本的Medical Devices Directive (93

医疗器械注册费是行政性收费,按照注册单元收取,部分省份不收取医疗器械注册费用,绝大部分省份还是收取的。本篇文章统计了截止到2022年1月5日各地医疗器械注册收费标准。

生物材料在疾病治疗和医疗保健中发挥了重要的作用,按材料性质,生物材料可分为惰性材料与可降解性材料两种,目前生物材料的发展呈现出由惰性向可降解性(水解和酶降解)转变的趋

为规范医疗器械(含体外诊断试剂)注册管理,根据国家药监局《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2021年第121号)、《关于公布体外诊断试剂注册申报
可吸收高分子材料介绍,及其在植入医疗器械中的应用。1、植入产品的定义国家食品药品监督管理局《医疗器械分类规则》(局令第15号)第八条中对“植入器械”的定义为:任何借助

审评时间 工作程序 审评工作程序 行政审批备案工作程序 项目管理人员公示信息 一、化药及生物制品 二、中药 审评业务联系邮箱 在审化药新药注册申请相关问题:huayaoxinyao@cde.org.c

一个产品带有CE 标志(标记) 也就意味着其制造商宣告:该产品符合欧洲的健康、安全、与环境保护之相关法律中所规定 的基本要求。因而该产品是对:使用者(译者注:人)、宠物(
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台