浅谈病例报告表设计/填写与更正(附病例报告表模板)
病例报告表(CRF)是临床试验中记录临床资料的表格,每一受试者有关试验的资料均应记录在预先按试验方案设计的病例报告表中。它们依据原始记录而填写,以便申办者对不同试验单
来源:医疗器械注册代办 发布日期:2023-11-27 阅读量:次
最近,听到一个很有意思的讨论,申办者能够改动病例报告表(CRF)中的数据吗?

大家一定知道CRF填写是研究者的职责,申办者怎么能够改动CRF中的数据呢,即使研究者CRF填写错误,不也应该是由研究者自己修改吗?所以第一反应肯定是:不可以。
但如果你仔细阅读中国2020版GCP,其中第二十五条第三款是这样描述的:申办者应当有书面程序确保其对病例报告表的改动是必要的、被记录的,并得到研究者的同意。研究者应当保留修改和更正的相关记录。
ICH GCP也有类似的描述:4.9.3 Sponsors should have written procedures to assure that changes or corrections in CRFs made by sponsor's designated representatives are documented, are necessary, and are endorsed by the investigator. The investigator should retain records of the changes and corrections.
既然GCP如此规定,则说明在某些特定情况下,申办者是可以改动CRF中的数据。具体来说还需要追溯到使用纸质CRF的年代,如下图所示,在一个2002年开展的临床试验中,数据管理员收集到的一页CRF如下:
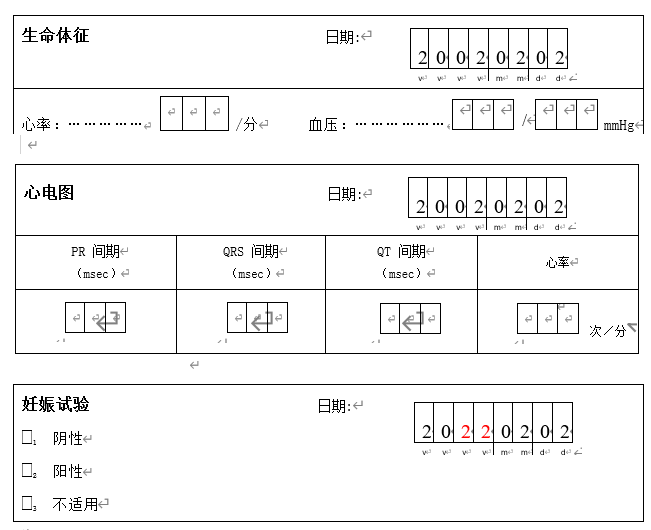
上图中妊娠试验的日期明显是错误的,从临床试验开展的时间和同一页CRF中研究者填写的生命体征和心电图的日期可以推断出,妊娠试验的正确日期应该是2002年2月2日。在这种情况下,如果申办者“有书面程序确保其对病例报告表的改动是必要的、被记录的,并得到研究者的同意”,则申办者的数据管理员就可以将妊娠试验的日期修改为2002年2月2日,我们通常称之为“自证明更正(Self Evident Corrections)”。
根据GCP的要求,自证明更正的前提是申办者需事先制定书面程序如SOP来规定在哪些必要的情况下,申办者可以通过哪些操作来改动CRF数据,并留下哪些记录。
其中,必要的情况一般需要满足以下条件:即申办者的数据管理员通过已经收集的CRF数据和其它试验信息可以确定CRF中的数据错误,并基于一定的规则可以推断出正确的数据是什么。例如上图中生命体征和心电图都是采集于2002年,这个试验的实施时间也是在2002年,则可以推断出正确的妊娠试验日期也应该是2002年。
具体操作流程必须能够体现:申办者的修改得到了研究者的同意,并被记录,而且相关记录被保存。
1、申办者应事先和研究者约定好在什么情况下申办者代表可以基于什么样的规则来修改CRF中的哪些数据,记录约定的文件一般称之为《数据处理约定Data Handling Convention》,申办者代表和研究者应共同签署这份文件。
2、在试验进行阶段,如果遇到以上约定的情况,申办者代表就可以修改相应的CRF数据,但应先完成一份文件《自证明更正Self Evident Corrections》,记录更正的原因和被更正的数据,并获得研究者的签字认可。
3、申办者和研究者应当保留修改和更正的相关记录,包括签署后的《数据处理约定Data Handling Convention》和《自证明更正Self Evident Corrections》。
从本质上来说,自证明更正也是一种CRF修改的方法,是申办者在获得研究者同意后对CRF数据的修改。其它CRF修改方法都是由研究者自己修改,例如:
1、研究者发现CRF填写错误后自己进行修改
2、监查员发现错误后告知研究者,由研究者进行修改
3、数据管理员使用数据质疑的方式,由研究者通过回答数据质疑的方式进行修改
之所以允许申办者自证明更正,其目的是为了加快数据处理的进程,因为在使用纸质CRF时,数据管理员收到纸质CRF后,如果通过数据质疑来修改CRF,耗时会比较久。而目前临床试验中基本采用EDC收集数据,一般就不会采取这种方式来修改CRF了。因为在EDC中解决数据质疑还是非常高效和快捷的。
通过以上讨论希望大家能够进一步理解学习法规的重要性,我们需要读懂法规的每一项条款,并知道如何将法规要求转化为具体的操作流程来指导工作实践。
来源:道一

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

病例报告表(CRF)是临床试验中记录临床资料的表格,每一受试者有关试验的资料均应记录在预先按试验方案设计的病例报告表中。它们依据原始记录而填写,以便申办者对不同试验单

俗话说“知己知彼,百战不殆”,对于作为CRC的我们,自认为对CRA其实已经很了解了,但是在我们工作过程有一个角色平时接触不到,但是却又绕不开躲不过,尤其是面对满屏EDC query的

病例报告表(case report form,CRF)是按照临床试验方案的要求设计的书面文件,用于记录和报告每一名受试者在试验过程中的数据,这种文件一般采用表格(纸质或电子)的形式。"

临床试验数据管理,是一项重要又复杂的工作,因为临床试验就是靠数据证明试验产品的成功与失败。临床数据管理(Clinical Data Management, CDM)是临床研究中的一个关键过程,它能从临床

电子数据采集(electronic data capture,EDC)是电子化临床试验的重要组成部分。EDC通过计算机、局域网、因特网、PDA和各种便携式设备、互动式语音或网络应答系统及远程数据输人(remoted

ICH-GCP将病例报告表(CRF)定义为一种印刷的、可视的或者是电子版的文件,用于记录每个受试者的所有试验方案要求的信息,向申办者报告,CRF是医疗器械临床试验数据采集重要的必备
医疗器械唯一标识(UDI)贯通医疗器械生产经营使用各环节,能确保医疗器械生产和使用安全,是医疗器械非常有用的身!份!信!息!作为医疗器械的身份证,有需要的小伙伴怎么可

临床数据管理员(DM)能力和要求?数据管理员在整个临床研究中要密切注意研究中的关键变量的数据质量,确保它们百分之百准确无误。此外,临床研究方案还应该对试验的质量控

医疗器械临床试验在近年被大家熟知,作为医疗器械上市前重要的一环,其涉及的领域非常广泛,随之产生了各种各样的角色。CRA和DM的接触,基本仅限于在EDC系统中打个照面。CRC稍多一

前言:设计良好的CRF,不仅大大简化数据库的设计,减少数据库之间的转换,还能够提供大量的临床研究信息,简化统计分析,增加采集数据的可读性,减少填写数据时的错误...... 一、
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台