谈谈医疗器械产品的寿命界定方法
医疗器械的使用寿命是指医疗器械从规划、设计、生产、销售、安装调试到使用、维修、维护检测、报废的全过程。而医院使用的医疗器械的应用质量和安全管理在整个寿命过程中占重
来源:医疗器械注册代办 发布日期:2025-08-10 阅读量:次
在我国医疗器械监管体系中,体外诊断试剂实行分类管理,依据风险程度划分为第一类、第二类和第三类。科学准确地进行分类界定是企业产品注册的关键起点,目前主要参考以下三类权威文件。
国家药监局2021年第129号公告发布的《体外诊断试剂分类规则》(以下简称《规则》)是分类工作的核心依据。该规则明确以风险程度为分级基础,将影响因素归纳为三个方面:预期用途及使用环境、检验结果对医学决策的影响程度、以及错误结果对个人或公共健康的潜在危害。
《规则》第六条详细划分了三类试剂的具体范围。第一类涵盖低风险辅助试剂,如非鉴别用途的微生物培养基、核酸提取试剂等;第二类包含多数生化检测试剂(如蛋白质、激素、维生素检测试剂);第三类则针对高风险场景,包括病原体检测、基因检测、肿瘤标志物、毒麻药品检测试剂等。需特别注意的是,同一试剂因用途不同可能类别升级。例如,用于肿瘤诊断的第二类试剂将自动归入第三类管理;检测吗啡等毒麻药品的试剂无论技术原理均属第三类。该文件是判定新产品类别或重新评估在售产品类别的首要依据。
作为《规则》的具体延伸,《体外诊断试剂分类目录》对已上市产品进行系统归类并动态更新。现行有效的2025版目录中,对二代基因测序试剂等新兴技术进行了专项细化。例如:
1、核酸提取纯化试剂(第一类):采用磁珠法、柱提法等通用方法,不含特异性探针;
2、文库构建试剂(第三类):包含靶向性引物/探针,主导检测特异性,要求整体申报不得拆分;
3、测序反应通用试剂(第一类):仅含通用测序引物酶类,需标注适配的已注册测序仪型号。
目录的修订动态直接反映监管趋势。2024年通告要求,凡依据新目录需变更管理类别的产品,须在2027年1月1日前完成注册转换,否则禁止销售。
国家药监局医疗器械标准管理中心定期发布的分类界定结果汇总,是解决争议案例的实践指南。这些汇总文件收录了数百例具体产品的分类意见,例如:
1、流式细胞仪用抗体试剂:辅助诊断用途的单一抗体试剂属第一类,而诊断用途的抗体组合试剂盒则按第二或第三类管理;
2、药物代谢物检测试剂:检测氯胺酮等精神药品的试剂明确归为第三类,而普通治疗药物检测试剂属第二类。
企业申报新产品时,可通过比对这些汇总中的相似产品案例,预判分类结果。对于无明确先例的产品,需按《规则》第十条向药监局申请分类界定确认。
表:体外诊断试剂分类管理要点对比
| 分类依据 | 风险程度 | 管理方式 | 代表产品 |
|---|---|---|---|
| 第一类 | 较低个人风险,无公共健康风险 | 备案管理 | 微生物培养基、样本处理试剂(溶血剂/稀释液)、核酸提取试剂 |
| 第二类 | 中等个人/公共健康风险 | 注册审批(省级) | 蛋白质/糖类检测试剂、激素检测试剂、普通药物代谢物检测试剂 |
| 第三类 | 较高个人/公共健康风险 | 注册审批(国家级) | 病原体检测试剂、人类基因检测试剂、毒麻药品检测试剂、肿瘤标志物检测试剂 |
目前可以参考的体外诊断试剂分类界定文件主要包括三类:(1)《体外诊断试剂分类规则》;(2)《体外诊断试剂分类目录》;(3)标管中心历次医疗器械产品分类界定结果汇总。企业需结合规则框架、目录明细及历史界定案例,构建完整的分类证据链,方能在注册申报中精准定位产品管理类别。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
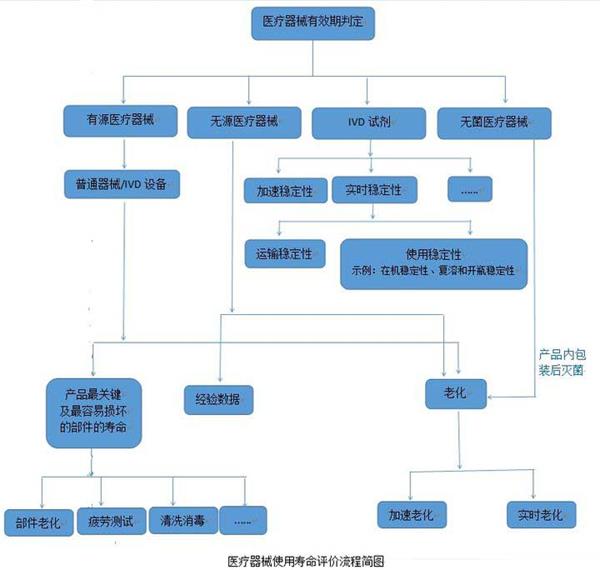
医疗器械的使用寿命是指医疗器械从规划、设计、生产、销售、安装调试到使用、维修、维护检测、报废的全过程。而医院使用的医疗器械的应用质量和安全管理在整个寿命过程中占重

随着医疗器械出口的日益增长,根据市场的需求各医疗器械生产厂商需要符合国家和地区的质量体系法规越来越多,所以经常会碰到出处于不同法规或标准的一些比较容易混淆的概念及

医用冷敷贴可以每天使用,但是不建议长期每天使用。医用冷敷贴安全性比较高,而且功效也明显,更适合皮肤出现问题的时候使用,如果皮肤没有什么皮肤问题,使用起来可能和一般

临床试验从筛选到立项、启动、入组和中心关闭是一个完整的闭环,什么时候可以开始关闭中心?关闭中心需要做哪些事情?从哪里着手?今天我们就来谈一谈临床试验关中心阶段的那

脱落是每个临床试验中都会出现并且也最让人头痛的现象。但是是什么原因引起脱落而我们怎么才能减少脱落呢?那么我们来谈一下,项目中常见的脱落问题,希望能为各位项目人员提

皮肤出现问题每个人都会很在意,不仅是疼痛不好受,脸上出现红肿或发炎都是会影响到自己的整体美观,谁不想美美的呢。特别是换季时温差比较大,皮肤很容易出现问题,这种情况

我国GCP的附录中也列出了类似必备文件,详细内容读者可以参考这两个规范的附录部分。——《药物临床试验与GCP实用指南》......下面介绍研究者应当保存的重要文件及要求。"

病例报告表(case report form,CRF)是按照临床试验方案的要求设计的书面文件,用于记录和报告每一名受试者在试验过程中的数据,这种文件一般采用表格(纸质或电子)的形式。"

在临床试验方案的设计过程中,大家都会尽可能的考虑到各种可能影响试验的因素,并制定标准操作规程,尽量避免和减少在试验中可能出现违背及偏离方案的情况发生,但在试验的执

市面上销售的面膜主要有妆字号面膜和械字号面膜,医用冷敷贴面膜属于械字号面膜。医用冷敷贴面膜的功能在于受损肌肤修正,用于湿疹、过敏等皮肤状态,起到一个辅佐医治的作用
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台