临床试验中的单盲、双盲、三盲、破盲是什么意思?
盲法试验常用的有两种:单盲(single blinding)和双盲(double blinding),更严格的对照试验要用到三盲(triple blinding),在对照药物和试验药物剂型或外观不同时,还要用到双盲双模拟技
来源:医疗器械注册代办 发布日期:2021-11-08 阅读量:次
研究者是临床研究的主体,因此选择研究者是临床试验成败的关键环节,无论在医院还是在专业研究机构进行,高质量的研究必须由有责任心和经验的研究者才能完成。在试验方案的定稿阶段就应当确定研究者。
选择研究者时,应当优先考虑与申办者有过很好的合作关系,而且具有良好研究信誉记录的研究者。可通过同行推荐,参阅发表的临床文献来确定合适的专业人选。
我国《药品管理法实施条例》及《药品注册管理办法》规定:临床研究经国家食品药品监督管理局批准后,申请人应当在经依法认定的具有药物临床试验资格的机构中选择承担临床试验的机构。因此,在选择研究者时,首先应当考虑候选对象所在的单位及专业科室是否具有承担药物临床试验的资格。这也是我国不同于国际上大多数国家之处。在我国对研究者的选择实际上在某种程度上变成了对依法认定的研究机构及专业的选择。2004年2月SFDA会同卫生部发布了药物临床试验机构资格认定办法(试行)》并自2004年4月开始,开展了资格认定工作。医疗器械临床试验虽没有强制说明,但在项目进行过程中按此规定进行。

●是否具备开展临床试验的专业背景和经验,所在医疗机构和专业室是否具备承担临床试验的资格;
●是否熟悉GCP和有关法规;
●是否有足够的受试者来源,如已在或准备承担类似药物的试验项要考虑到互相竟争受试者的情况;
●是否能够保证投入足够的研究时间;
●是否能够有效地支配所在医疗机构的资源、包括项目所需的协辅助人员,例如助理研究人员、药剂师、检验或化验员等和必要的医疗、检查检验设施和设备,包括需要的特殊仪器设备;是否具备必要的试验药物/医疗器械和研究资料的储存,保管条件;
●是否建立了开展临床试验的各项管理制度和标准操作属程;
●研究中心的位置是否方便大部分潜在受试者的随访和监查员的访视;
●是否具有良好的研究信誉记录,承担过的临床试验是否被官方查处过等。
药物/医疗器械生产企业在选择研究者时往往把目光集中在一些临床权威或名人身上。无疑这些权威具有很高的学术造诣和专业经验,因此所承担的临床研究能够很好地开展,其研究的结果容易得到药品监督管理部门的认可。但另一方面,却可能造成研究课题过度集中,这样主要研究者花费在每一课题上的时间和精力相对不足,也可能对试验质量带来负面的影响,例如有时会导致入选受试者上的困难,从而使研究延误。

研究者是临床试验取得成功的关键因素,在一定程度上临床试验是否顺利面高质量地完成,主要取决于研究者。因此各国或国际组织的GCP均对研究者的资格、能力与职责做了具体的规定。
从事临床试验的研究者必须具备一些必要的条件,主要包括专业资格和经验,对试验设施、设备和人员的支配能力,能够保证研究时间以及具备人选病人的条件。
我国GCP规定负责临床试验的主要研究者(PI)应当具备下列条件:
●在合法的医疗机构中具有任职行医资格;
●具有试验方案中所要求的专业知识和经验;
●对临床试验具有丰富经验或者能得到本单位有经验的研究者在学术上的指导;
●熟悉申办者所提供的与临床试验有关的资料与文献;
●有权支配参与该项试验所需要的人员和设备;
●熟悉GCP,遵守国家有关法律、法规与道德规范;
●必须在有良好医疗设施、实验室设备、人员配备的医疗机构进行临床试验,该机构应具备处理紧急情况的必要设施以确保受试者的安全。
按照我国《药品管理法实施条例》及《药品注册管理办法》,承担药物临床试验的机构必须是经依法认定具有药物临床试验资格的机构。也就是说,除了具备上述条件外,研究者还必须在依法认定的临床试验机构工作。

研究者应当具备足够的从事临床试验的时间。研究者需要耗费大量的时间进行下列工作:
●了解和熟悉试验方案及其他有关资料;
●定期和申办者委派的监查员会晒;
●发现并筛选合适的受试者,执行知情同意;
●在病人(受试者)身上花费比普通病人更多的时间;
●协调研究人员间的工作并评估试验的进程;
●填写各种要求的文件并处理试验产生的资料;
●接受监查员、稚查员和检查员的监查、稽查和检查等。
研究人员还应当具备可靠的受试者来源。如果保证不了适当的病人入选数量和速度,必然会影响试验的进度和质量。因此,在选择研究者时要考虑研究者是否已承担过类似的临床项目。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

盲法试验常用的有两种:单盲(single blinding)和双盲(double blinding),更严格的对照试验要用到三盲(triple blinding),在对照药物和试验药物剂型或外观不同时,还要用到双盲双模拟技

刚接触CRO行业的小伙伴,在学习文件法规资料的同时,常看到一些英文类专业名词不知道是什么意思。下面,一起看看常见的临床试验专业术语: CRO行业的常用术语解释: 1:新药研发

医学的进步是以研究为基础的,这些研究在一定程度上赖于以人作为受试者的试验。--《赫尔辛基宣言》。Ⅰ期临床研究目的是确定可用于临床新药的安全有效剂量与合理给药方案。根据

SSU是Study Start Up的缩写,从最初的项目准备,到启动访视(Site Initiation Visit)之前所有的准备工作,对整个临床研究项目的启动非常关键。负责这个关键阶段工作的部门人员,就叫做SS
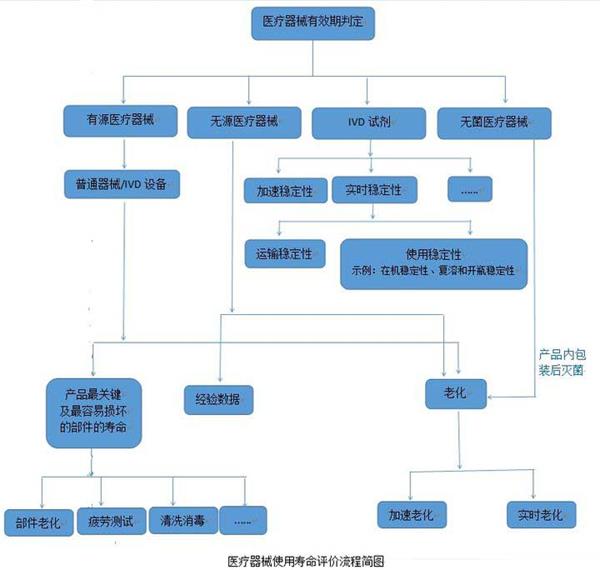
医疗器械的使用寿命是指医疗器械从规划、设计、生产、销售、安装调试到使用、维修、维护检测、报废的全过程。而医院使用的医疗器械的应用质量和安全管理在整个寿命过程中占重
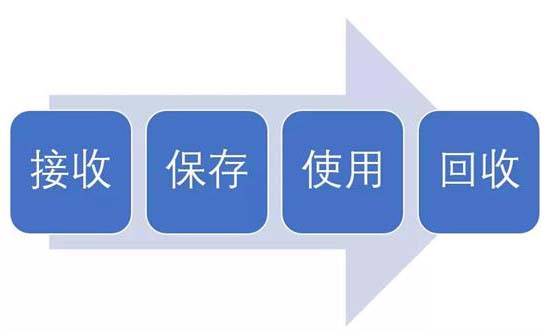
试验用药品是指用于临床试验的试验药物、对照药品。试验用药品渗透到了临床试验过程中的每一个步骤,包括药物的生产、包装、运输、保存、使用、回收等。今天我们从临床试验中

不知道你是否有这样的经历,去医院看病,医生开药写的都是服药中文说明。但药物临床试验相反,有些研究者喜欢写医嘱缩写,比如pc,我第一次看到就不知道什么意思,作为一个好奇

不少二三类需要临床的产品,客户一听到临床报价就退缩。既然这么贵,还不如自己做......事实真的是这样吗?临床报价费用都由哪些组成?费用都谁收走了?自己做又有哪些风险?文

刚接触医疗器械CRO行业的小伙伴,在学习文件法规资料的同时,常看到一些英文类专业名词不知道是什么意思。下面,一起看看常见的医疗器械临床试验专业术语......"

在临床试验中,无论是监查员、质控人员或者项目管理人员到研究中心查看项目资料的时候,总会多多少少发现一些问题,有些问题可能大家都比较熟知,但处理手法五花八门的。处理
行业资讯
知识分享
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台
