有源医疗器械加速老化试验效期验证及使用期限验证流程
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次

医疗器械的安全有效使用直接关系医疗质量安全和人民群众身体健康。根据《医疗器械监督管理条例》(以下简称《条例》)有关规定,卫生健康主管部门依据职责,对医疗器械使用行为进行监督管理。2010年,原卫生部制定发布《医疗器械临床使用安全管理规范(试行)》(卫医管发〔2010〕4号)。该管理规范实施以来,在加强医疗器械临床使用的规范管理方面发挥了很好的作用,并且在完善医疗机构医疗器械使用管理制度以及明确医疗器械临床使用不同环节管理要求等方面积累了很多有效经验。为进一步贯彻落实《条例》有关规定,将医疗器械临床使用管理中的有效经验上升为部门规章,加强医疗机构医疗器械临床使用管理工作,保障医疗器械临床使用安全、有效,结合卫生健康主管部门职责,制定本办法。
《医疗器械临床使用管理办法》共分八章,分别是:总则、组织机构与职责、临床使用管理、保障维护管理、使用安全事件处理、监督管理、法律责任和附则,共五十一条。
(一)关于总则。明确立法目的是为加强医疗器械临床使用管理,保障医疗器械临床使用安全、有效。明确国家卫生健康主管部门和地方卫生健康主管部门医疗器械监督管理的职责划分。明确医疗机构主要负责人是本机构医疗器械临床使用管理的第一责任人,要求医疗机构建立并完善本机构医疗器械临床使用管理制度,对医疗器械实行分类管理。
(二)关于组织机构与职责。明确规定卫生健康主管部门和医疗机构组织机构建设方面的责任。明确医疗机构相关部门、科室和人员在医疗器械临床使用管理方面的职责,并规定医疗机构配备专业人员、相关专业人员的资格条件以及使用科室职责等。规定了医疗机构组织开展医疗器械临床使用管理继续教育和培训、加强信息管理以及开展自查、评估、评价等方面的职责。
(三)关于临床使用管理。明确医疗机构在医疗器械评估、购进、安装及验收等环节中的职责,要求医疗机构建立医疗器械验收验证制度。明确医疗机构及其医务人员临床使用医疗器械的原则、规范及注意事项等。要求医疗机构建立医疗器械临床使用风险管理制度,对生命支持类等重点医疗器械实行使用安全监测与报告制度,对大型医疗器械以及植入和介入类医疗器械进行病历记录,开展医疗器械临床使用评价,对存在安全隐患的医疗器械立即停止使用并通知维修。
(四)关于保障维护管理。明确医疗器械保障维护管理应当重点进行检测和预防性维护,医疗机构应当记录和分析维护与维修记录,同时应当具备与医疗器械品种、数量相适应的贮存场所和条件。
(五)关于使用安全事件处理。明确了医疗器械使用安全事件可疑即报和及时报告的原则;根据医疗器械使用安全事件产生的损害程度不同规定了不同的处理程序;对影响较大的,县级以上地方卫生健康主管部门可以采取风险性提示、暂停辖区内医疗机构使用同批次同规格型号的医疗器械,以有效降低风险。
(六)关于监督管理、法律责任及附则。明确县级以上地方卫生健康主管部门应当加强对医疗机构医疗器械临床使用行为的监督管理并明确了有权行使的相关职责;规定县级以上地方卫生健康主管部门应当组织对医疗机构医疗器械临床使用管理情况进行定期或不定期抽查。对违反本办法规定的违法行为规定了相应处罚。在附则中明确了医疗器械使用安全事件的概念和调整范围。在附则中对医疗器械使用安全事件的概念进行了界定;对于《办法》的调整范围进行了明确。
相关法规:
医疗器械临床使用管理办法(国家卫生健康委员会令第8号)

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
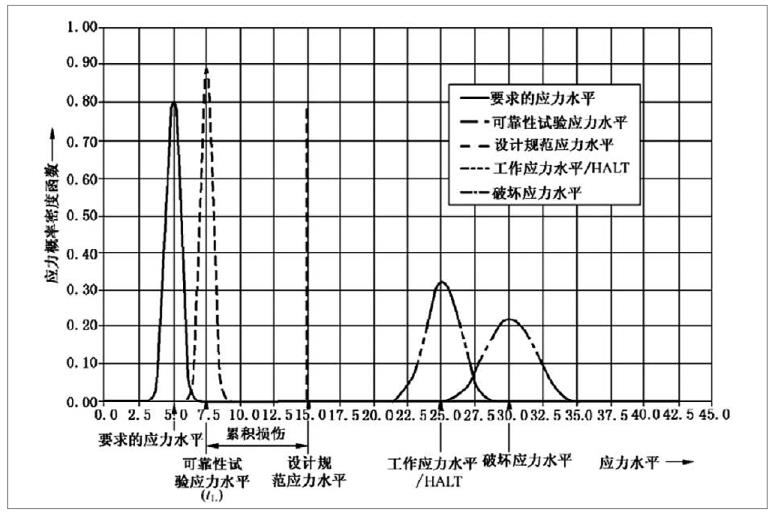
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有

国家市场监管总局于官网公布《药品注册管理办法》(以下简称“办法”)已于2020年7月1日起正式施行。国家药监局从《办法》修订的背景、思路、引入了哪些新理念和制度、有哪些鼓

润滑剂类产品在美国根据产品预期用途的不同主要分为人体润滑剂和患者润滑剂:其中,人体润滑剂主要成分为水、丙二醇、羟乙基纤维素、苯甲酸、卡波姆、氢氧化钠等,作用于生殖

中国能排进世界十大医疗器械制造强国吗?暂时还不能,因为排进前十的国家都有许多知名械企和世界级医疗器械巨头;而中国比较出名的可能只有迈瑞了,其他械企仍需努力了。下面

简述了中药新药临床试验主要特点,指出要重视风险、受益评估,重视人 用经验选择科学、客观、合适的有效性指标,做好中医证候疗效评价,鼓励在中药新药临床研究中采用电子化手

本文介绍了欧盟医疗器械新法规MDR相比于将替代的MDD法规的几点新增要求。建议收藏学习。明年5月份起,Medical Devices Regulation(MDR)(2017/745/ EU)将替代原本的Medical Devices Directive (93

医疗器械注册费是行政性收费,按照注册单元收取,部分省份不收取医疗器械注册费用,绝大部分省份还是收取的。本篇文章统计了截止到2022年1月5日各地医疗器械注册收费标准。

生物材料在疾病治疗和医疗保健中发挥了重要的作用,按材料性质,生物材料可分为惰性材料与可降解性材料两种,目前生物材料的发展呈现出由惰性向可降解性(水解和酶降解)转变的趋

为规范医疗器械(含体外诊断试剂)注册管理,根据国家药监局《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2021年第121号)、《关于公布体外诊断试剂注册申报
可吸收高分子材料介绍,及其在植入医疗器械中的应用。1、植入产品的定义国家食品药品监督管理局《医疗器械分类规则》(局令第15号)第八条中对“植入器械”的定义为:任何借助
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台