体外诊断试剂ivd的贮存条件和运输要求
在我国,体外诊断试剂(IVD)是指:可单独使用或与仪器、器具、设备或系统组合使用, 在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中, 用于对人体样
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
引言:2020年12月18日,药监总局发布2项医疗器械注册答疑,其中一项是血管内造影导管的动力注射要求,一起来看看。
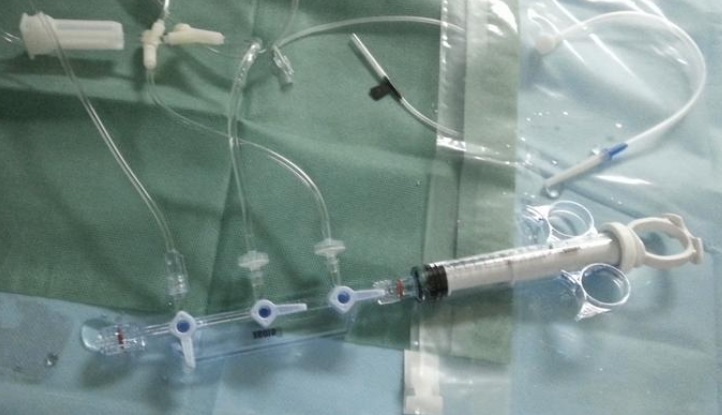
1)对于采用高压注射装置注射的造影导管产品,需在技术要求和说明书(标签)中标注最大爆破压力信息,同时按照YY0285.1-2017对动力注射要求进行规定。
2)对于采用环柄注射器注射造影剂的造影导管产品,可不制定动力注射要求。宜在说明书中明确以下警示:请勿使用高压注射装置注射造影剂。
适用范围中包含血管造影功能的其他导管,宜参照以上要求。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

在我国,体外诊断试剂(IVD)是指:可单独使用或与仪器、器具、设备或系统组合使用, 在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中, 用于对人体样

从广义讲,远程审核指使用远程信息和通信技术提供完整的认证信息与服务,包括诸如远程受理、远程审核、远程认证审核信息共享等所有认证审核活动;其中管理的重点和难点主要为

本文介绍了欧盟医疗器械新法规MDR相比于将替代的MDD法规的几点新增要求。建议收藏学习。明年5月份起,Medical Devices Regulation(MDR)(2017/745/ EU)将替代原本的Medical Devices Directive (93

2016年起,医疗机构对有冷链要求的体外诊断试剂实施了入库验收制度,要求供应商按照医院规定的时间将产品送到科室,必须由试剂管理部门验收人员、科室人员双方一起验收,验收要

随着医疗器械分类及免临床医疗器械目录的调整,部分电子内窥镜产品的管理类别从III调整为II类,同时列入免于进行临床试验的医疗器械目录,因此在注册申报过程中,其注册申报要求

为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了《一次性使用高压造影注射器及附件产品注册审查指导原则》《金属接骨板内固
对于医疗器械领域来说,创新是永远的话题。随着集采风暴压境,越来越多高值耗材进入低值时代,医械行业的创新进程也开启了加速模式。对于械企来说,要想更长远的发展,必须创

2021年1月11日,欧盟委员会在欧洲联盟官方公报上发布了关于公告机构进行质量管理体系审核的相关通知。"

YY 9706.274-2022《医用电气设备 第 2-74 部分:呼吸湿化设备的基本安全和基本性能专用要求》等3项医疗器械行业标准已经审定通过,现予以公布。标准编号、名称、适用范围和实施日期见
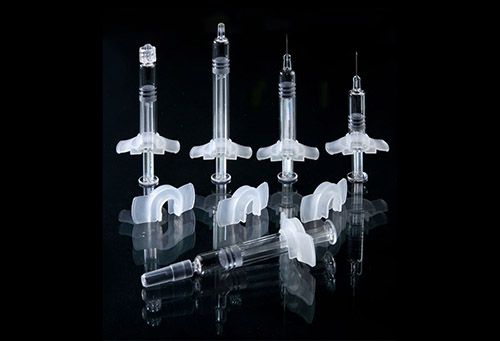
目前,涉及预灌封注射器相容性研究的指导原则包括化学药品注射剂与塑料包装材料相容性研究技术指导原则、化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则与化学药品
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台