分享肿瘤评估表CRA监查经验和心得
众所周知,“肿瘤项目经验”这几年了CRA跳槽市场上的“硬通货”,本文将对其中的肿瘤评估表进行介绍,希望能将自己的监查经验以及对RECIST 1.1(实体肿瘤的疗效评价标准 1.1版)及
来源:医疗器械注册代办 发布日期:2023-11-28 阅读量:次
远程监查是相对于现场监查而言的,即不去研究中心现场,而是在申办者/CRO办公室就能完成的监查。近几年远程监查为大家所热议,听到一种声音说要能够进行远程SDV(Source Data Verification)才能够做远程监查,不解决远程SDV就无法进行远程监查,这一观点是不正确的。

让我们从远程监查的来源说起,那就是基于风险的监查(Risk-Based Monitoring),更加规范的说法应该是中心化监查(以下均用中心化监查替代远程监查)。美国FDA有一个指南《Oversight of Clinical Investigations —A Risk-Based Approach to Monitoring》,其中就说到“Risk-based monitoring : monitoring activities that reflect a modern, risk-based approach that focuses on critical study parameters and relies on a combination of monitoring activities to oversee a study effectively. Ordinarily, it would include a mix of centralized and on-site monitoring practices”。翻译过来就是:“通常来说,基于风险的监查包含现场监查和中心化监查”。
了解了来源,那如何进行中心化监查呢?
1、《Oversight of Clinical Investigations —A Risk-Based Approach to Monitoring》有指导:“Centralized monitoring is a remote evaluation carried out by sponsor personnel or representatives (e.g., clinical monitors, data management personnel, or statisticians) at a location other than the sites at which the clinical investigation is being conducted”。这里有一个很重要的点,就是参与中心化监查的,除了监查员,还有数据管理和统计人员。
2、GCP(2020版)第49条也提供了指导:“中心化监查是及时的对正在实施的临床试验进行远程评估,以及汇总不同的临床试验机构采集的数据进行远程评估。中心化监查中应用统计分析可确定数据的趋势,包括不同的临床试验机构内部和临床试验机构间的数据范围及一致性,并能分析数据的特点和质量,有助于选择监查现场和监查程序。”
以上法规要求告诉我们以下3点:
第一点:为什么要数据管理和统计人员参与?
中心化监查是“汇总不同的临床试验机构采集的数据进行远程评估”。要汇总各临床试验机构采集的数据(如EDC数据),则数据管理必须参与;同时“中心化监查中应用统计分析可确定数据的趋势”,所以统计人员也必须参与。
第二点:中心化监查评估的对象是“不同的临床试验机构采集的数据”。
“不同的临床试验机构采集的数据”不仅包括EDC中的数据,其实也包括其它电子化系统的数据,如IWRS系统中发放给受试者的药物数据、药物警戒系统中收集的安全性数据等。“不同的临床试验机构采集的数据”并不特指原始数据。
第三点:中心化监查评估的目的是“分析数据的特点和质量,有助于选择监查现场和监查程序”。
即通过分析“不同的临床试验机构采集的数据的特点和质量”,从而得出数据的趋势。如某个中心的方案违法特别多、数据疑问特别多且明显高于其他的研究中心等,其结果就是识别出风险比较高的中心,从而有针对性的进行现场监查。所以中心化监查的目的并不是核查原始数据的准确性,也就不一定要做远程SDV。
从以上的阐述可以得出结论,不需要进行远程SDV,我们就可以进行中心化监查。
下面这个图可以帮助大家更好的理解中心化监查和现场监查的关系:
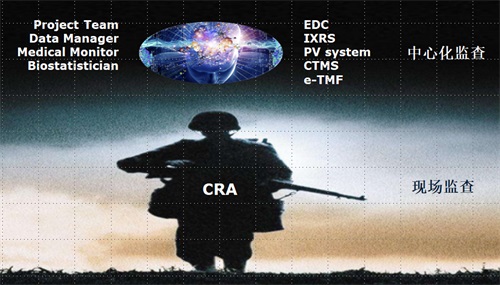
数据管理、统计人员、监查员和医学人员在办公室审核各个电子系统中从不同的临床试验机构采集的数据,分析数据的特点和质量,识别出风险比较高的中心(即中心化监查),然后派监查员有针对性的进行现场监查。
要采取中心化监查的方式,申办者或者CRO至少应具备以下条件:
1、人员准备:要配备懂得中心化监查的数据管理、统计人员和监查员等,并且有风险管理的意识。
2、流程准备:要事先制定中心化监查的相关流程。
3、系统准备:要配备必要的电子化系统如EDC、IXRS、CTMS和e-TMF等,而且这些系统应能够相互协同,以便于数据的分析和分享。
有了中心化监查,我们可以提高监查的效率,这也是基于风险的监查的主要目的。下次有机会再和大家聊一下基于风险的监查。
来源:道一

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

众所周知,“肿瘤项目经验”这几年了CRA跳槽市场上的“硬通货”,本文将对其中的肿瘤评估表进行介绍,希望能将自己的监查经验以及对RECIST 1.1(实体肿瘤的疗效评价标准 1.1版)及

小伙伴们是不是有些时候会迷糊,CRA/PM一会说SDV,一会说SDR,这到底是有啥区别呢?其实“天下的月亮一样圆”,这不只是我们国内是这情况,连首发RBM理念的国外小伙伴也是一样处境

盲态监查在于项目整体范围的监查,非盲监查在于药品相关的原始资料的监查。虽然在整个双盲的临床试验中,非盲监查负责内容不多,但却至关重要,毕竟严格按照方案使用药物,是

临床试验监查员由申办方派出,可以是第三方委托,但不能与CRC临床协调员出自同一公司。CRC和CRA市临床试验过程中不可缺货的两人,两人工作上分工明确,CRC主要负责沟通协调主研、受试者、

本文章主要从笔者作为CRA在SSU阶段进行合同拟定以及推动审核过程中积累的心得,来跟大家分享下,如有错误地方,请大家多多指教~

如题所示,如何写好监查报告?先看一下ICH-GCP1.38对于监查的定义:监督一个临床试验的发展,保证临床试验按照临床方案、标准操作规程(SOP)、临床试验质量管理规范(GCP)和相应的

知情同意,指受试者被告知可影响其做出参加临床试验决定的各方面情况后,确认同意自愿参加临床试验的过程。改过程应当以书面的、签署姓名和日期的知情同意书作为文件证明。对

全球范围内医疗器械临床试验远程监查的模式正在逐渐展开。但是,远程监查的开展必须有两个前提条件:一是有适合远程管理的新工具;二是各个临床研究点有成熟的临床研究管理经验。同时

一个好的eTMF,供应商可以让你的TMF看起来价值连城,从而大大提高项目的质量和效率。而一个糟糕的eTMF供应商可能会给你的临床团队带来压力,让你付出比金钱更多的代价。组织必须找

监查员(MONITOR),是申办者与研究者之间的主要联系人,是由申办者任命的有适当医学、药学或相关专业背景,并经过必要的训练,熟悉GCP及相关法规,其任务是监查和报告试验的进行
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台