医疗器械注册证信息怎么查询?
医疗器械注册证是依照法定程序,对拟上市销售、使用的医疗器械的安全性、有效性进行评价,决定同意其销售、使用后发放的证件,由国家食品药品监督管理总局统一制定。"
来源:医疗器械注册代办 发布日期:2023-11-27 阅读量:次
医疗器械是医疗领域中不可或缺的一部分,而三类医疗器械更是其中的重要组成部分。因此,对于从事医疗器械相关工作的人来说,了解和掌握三类医疗器械注册法规是必不可少的。本文将从基础到实践全面解析三类医疗器械注册法规,帮助您更好地了解和掌握相关法规,从而更好地开展医疗器械相关工作。

首先,让我们来了解一下什么是三类医疗器械。根据国家食品药品监督管理总局的规定,三类医疗器械是指具有较高风险,需要采取特别措施严格控制管理以保证其安全有效的医疗器械。常见的三类医疗器械包括植入式心脏起搏器、人工晶体、血管支架等。
那么,如何进行三类医疗器械注册呢?首先,申请人需要向国家食品药品监督管理总局提交申请材料,包括产品技术要求、产品检验报告、临床试验资料等。在提交申请材料之前,申请人需要确保所申请的三类医疗器械符合相关法规要求,包括产品安全有效性、质量可靠性等方面。如果申请通过了审核,申请人可以获得注册证,并可以在市场上销售该产品。
在了解三类医疗器械注册法规的过程中,我们需要重点关注以下几个方面:
1、注册流程:了解注册流程是进行三类医疗器械注册的基础。申请人需要按照流程要求,依次完成产品准备、申请提交、审核、批准等环节。在流程中,需要注意每个环节的具体要求和时间限制,以确保注册过程顺利进行。
2、法规要求:三类医疗器械注册法规要求严格,需要对产品安全性、有效性、质量可靠性等方面进行全面评估。申请人需要认真研读相关法规,了解具体要求和标准,以确保所申请的产品符合法规要求。
3、临床试验:临床试验是三类医疗器械注册的重要环节之一。申请人需要根据相关法规要求,进行科学严谨的临床试验,并对试验结果进行分析和评估。在临床试验过程中,需要注意伦理问题和患者权益保护。
4、培训与交流:为了更好地了解和掌握三类医疗器械注册法规,申请人可以参加相关的培训和交流活动。通过与业内专家和同行交流,可以深入了解法规要求和实践经验,提高自己的专业水平和实践能力。
总之,三类医疗器械注册法规是从事医疗器械相关工作必须掌握的知识。通过了解注册流程、法规要求、临床试验和培训与交流等方面,我们可以更好地掌握相关知识和技能,从而更好地开展医疗器械相关工作。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

医疗器械注册证是依照法定程序,对拟上市销售、使用的医疗器械的安全性、有效性进行评价,决定同意其销售、使用后发放的证件,由国家食品药品监督管理总局统一制定。"
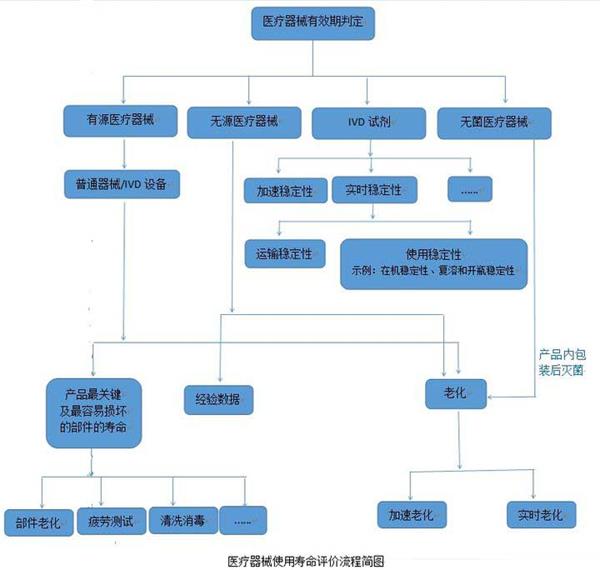
医疗器械的使用寿命是指医疗器械从规划、设计、生产、销售、安装调试到使用、维修、维护检测、报废的全过程。而医院使用的医疗器械的应用质量和安全管理在整个寿命过程中占重

从事医疗器械注册的小伙伴们可能都为同一个问题苦恼过,那就是医疗器械注册单元的划分。企业所设计开发出的产品,其所包含的产品范围,是否可通过一个注册单元完成注册,从而

随着医疗器械出口的日益增长,根据市场的需求各医疗器械生产厂商需要符合国家和地区的质量体系法规越来越多,所以经常会碰到出处于不同法规或标准的一些比较容易混淆的概念及

刚接触医疗器械CRO行业的小伙伴,在学习文件法规资料的同时,常看到一些英文类专业名词不知道是什么意思。下面,一起看看常见的医疗器械临床试验专业术语......"

目前,临床研究注册的要求是,前瞻性随机对照研究必须在研究开始前注册,观察性研究目前尚无统一要求,但有需要注册的趋势(脊柱外科前瞻性的研究不注册,文章一般很难发表,

脱落是每个临床试验中都会出现并且也最让人头痛的现象。但是是什么原因引起脱落而我们怎么才能减少脱落呢?那么我们来谈一下,项目中常见的脱落问题,希望能为各位项目人员提

病例报告表(case report form,CRF)是按照临床试验方案的要求设计的书面文件,用于记录和报告每一名受试者在试验过程中的数据,这种文件一般采用表格(纸质或电子)的形式。"

在临床试验方案的设计过程中,大家都会尽可能的考虑到各种可能影响试验的因素,并制定标准操作规程,尽量避免和减少在试验中可能出现违背及偏离方案的情况发生,但在试验的执

2019年5月31日,国家药监局发布了《关于实施医疗器械注册电子申报的公告(2019年第46号)》,从2019年6月24日正式实施电子申报,从11月1日起提交国家局的注册资料都需要按照电子申报目录
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台