网上销售情趣用品需要什么资质?什么证?
成人用品大多属于二类医疗器械,在网络销售成为情趣用品销售主要渠道的今天,除了办理二类医疗器械经营备案凭证之外,在网上销售情趣用品还要办理什么证吗?"
来源:医疗器械注册代办 发布日期:2023-11-27 阅读量:次
大家一定知道,在每本CRF(病例报告表)的最后都会有一份CRF审核声明,需要由每家中心的PI(主要研究者)进行签署,然后我们数据管理部门的同事才可以安心锁库。下图是一份CRF审核声明示例,不同试验中声明的措辞可能略有不同,但主要表达的意思是类似的:
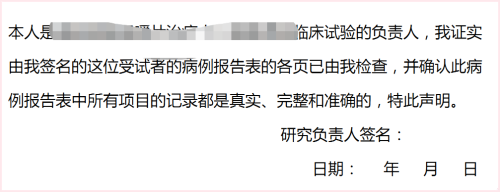
大家也一定都知道大部分PI是没有时间审核每一份CRF的,更不会去审核CRF中的每一页。但我们还是会要求PI去签署这份声明。明知不可为,为何又要为难我们的PI们呢?
似乎只要拿到了这份PI签署过的声明,就说明PI审核过CRF了,CRF中数据的质量就有保证了。不是说No documentation Not done(没有文件记录就相当于没有做)吗?怎么可以没有这份声明呢?
所以,必须拿到PI签署的这份声明,至于PI是否审核过CRF,或者说PI是如何确保数据质量的,大家倒并不如何关注了。
相信大家入行时,你们的前辈一定会反复给大家强调这句话:No documentation Not done,这也使很多人对这句话过分的解读和教条的执行,“Documentation”成了主要的追求,而忽略了临床试验质量的本质。我们经常会看到,CRC(临床研究协调员)拿了厚厚一沓文件在PI专家门诊前排队等候。为了提高效率,还在需要PI签字的地方贴好条子,方便PI很容易找到并获得其签字。似乎只要PI签字了,就万事大吉了,临床试验就完满了。
其实,我们真正需要知道的是文件记录只是数据和信息承载的一种形式,是质量的重要组成部分,但并不代表质量的全部,并不是说有了文件记录就等于做了,更不等于做到位了,或者说质量就有保证了。正如GCP所要求的那样,临床试验的质量本质是过程规范,数据和结果的科学、真实、可靠,而非仅仅是一堆看似“完美”的记录。

PI的职责是按照GCP的要求,采取措施确保临床试验过程合规,数据和结果的科学、真实、可靠。这是无法靠签署声明或者其它任何文件所能达到的,而需要切切实实的去做一些事情,例如:
1、在临床试验启动阶段,PI应授权有资质的人员承担临床试验相关职责,协助完成临床试验;
2、PI应安排被授权人员接受适当的培训,使其能够胜任被授权的工作;
3、PI应建立流程对临床试验的执行和数据的收集进行有效的监管,并有书面的记录证明PI按照此流程进行监管;
4、PI应通过各种途径了解临床试验中存在的问题,如及时了解监查员的监查结果,机构内部的质控结果和稽查员的稽查结果(如适用),采取必要的措施改进并预防问题的再次发生。
PI只有尽责完成以上事项,才能够使临床试验真正达成GCP的质量目标。也许这时候我们的CRF审核声明可以改一下,让声明能够如实反映PI签字的含义,即“我做了什么、我对什么负责”。比如这样:
我已经采取了充分的措施来确保CRF数据质量,并对数据的真实性、准确性和完整性负责。
临床试验在中国发展很快,现在的临床试验中出现了一些奇怪的现象,比如CRC成了临床试验的主力军、研究者的主要工作是签字、CRA主要负责催进度、QC人员和稽查员开始做监查。这样的错位并不少见,但大家好像也都习以为常。为什么我们不能各司其职、各尽其责呢?这样临床试验的明天才会更加美好。
来源:道一

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

成人用品大多属于二类医疗器械,在网络销售成为情趣用品销售主要渠道的今天,除了办理二类医疗器械经营备案凭证之外,在网上销售情趣用品还要办理什么证吗?"

消字号”产品指的是消毒产品,主要用于杀灭或清除传播媒介上的病原微生物,是卫生部为提高公共卫生质量而批准的一类产品。由省一级卫生主管部门审核批准,是经过卫生部门批准

化妆品分为国产和进口、又分为非特殊化妆品和特殊化妆品,备案的费用和周期各不相同,具体各类化妆品备案多少钱?周期要多久?看完就懂了......

临床试验从筛选到立项、启动、入组和中心关闭是一个完整的闭环,什么时候可以开始关闭中心?关闭中心需要做哪些事情?从哪里着手?今天我们就来谈一谈临床试验关中心阶段的那

病例报告表(case report form,CRF)是按照临床试验方案的要求设计的书面文件,用于记录和报告每一名受试者在试验过程中的数据,这种文件一般采用表格(纸质或电子)的形式。"

近期,全国多地对成人用品合规销售开展抽查,多个无证销售企业被行政处罚。本文说说拼多多上成人用品销售,需要办理的资质有哪些?

大家在项目中,是否遇到过ICF更新的情况?在ICF更新后,已由受试者签署的知情同意书,是否需要重新签署呢?又有哪些情形不需要重新签署呢?本期我们继续跟大家分享知情同意书实

知情同意对从事临床的CRC来说,并不陌生。日常工作中每时每刻都在与临床试验受试者沟通交流,那么你知道知情同意书签署注意事项及核查要点吗?我们先来区分知情同意和知情同意
为保障医疗器械产品经营过程中的质量安全,国家要求在医疗器械采购、验收、贮存、销售、运输、售后服务等环节均需符合GSP规定。从事第三类医疗器械经营的企业还应当具有符合医疗器械经

ICH-GCP将病例报告表(CRF)定义为一种印刷的、可视的或者是电子版的文件,用于记录每个受试者的所有试验方案要求的信息,向申办者报告,CRF是医疗器械临床试验数据采集重要的必备
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台