国内凝血分析流水线产品盘点(沃芬/希森美康/思塔高和艾科达)
随着国家医疗改革的不断深入,使得综合性大中型医疗机构的中心实验室对自动化系统有了新的要求,为了简化检测流程,提高检测效率,保证数据准确度等,中心实验室对集中化诊断
来源:医疗器械注册代办 发布日期:2025-06-03 阅读量:次
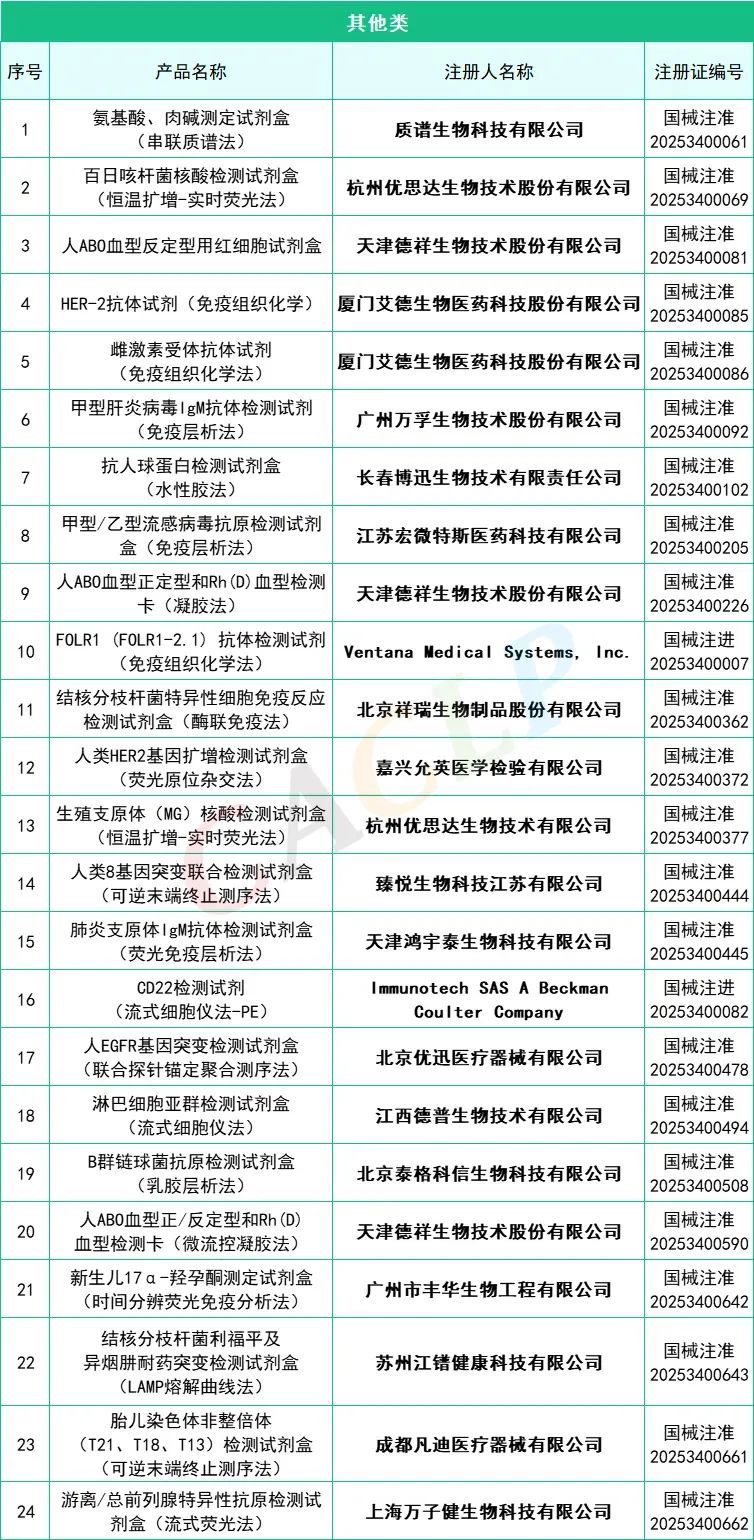
2025年一季度药监局共批准872个新品,IVD产品共有145个,仪器系统类共有15个,质控品、校准品、对照品、定标品共有10个,化学发光法试剂共有35个,PCR试剂共有46个,胶体金法共有15个产品,其他方法试剂共有24个。其中深圳迈瑞生物医疗电子股份有限公司共有10款产品获批,郑州安图生物工程股份有限公司共有9款产品获批,厦门万泰凯瑞生物技术有限公司和山东康华生物医疗科技股份有限公司分别有4款产品获批。详细情况如下:
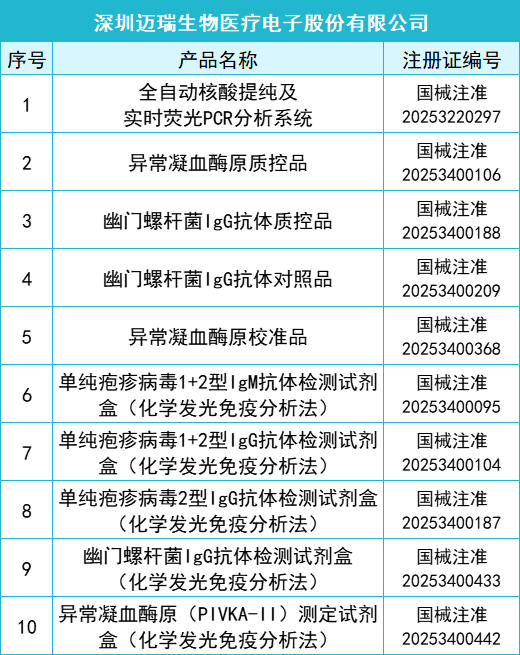
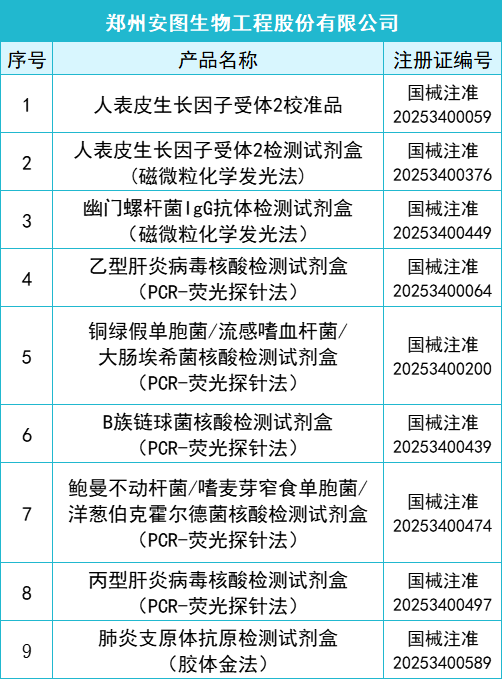
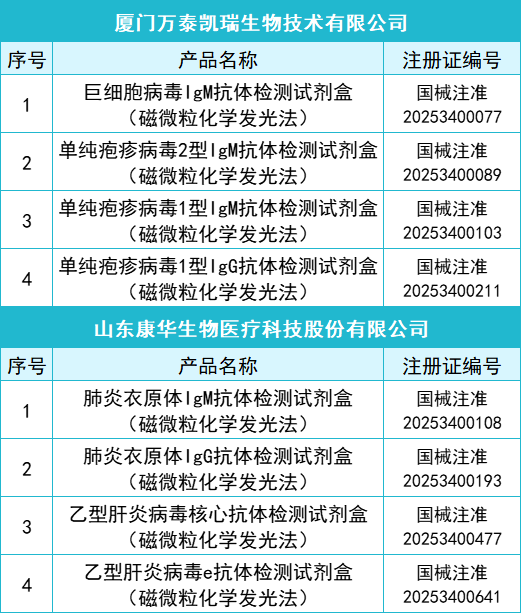
全部获批IVD产品:
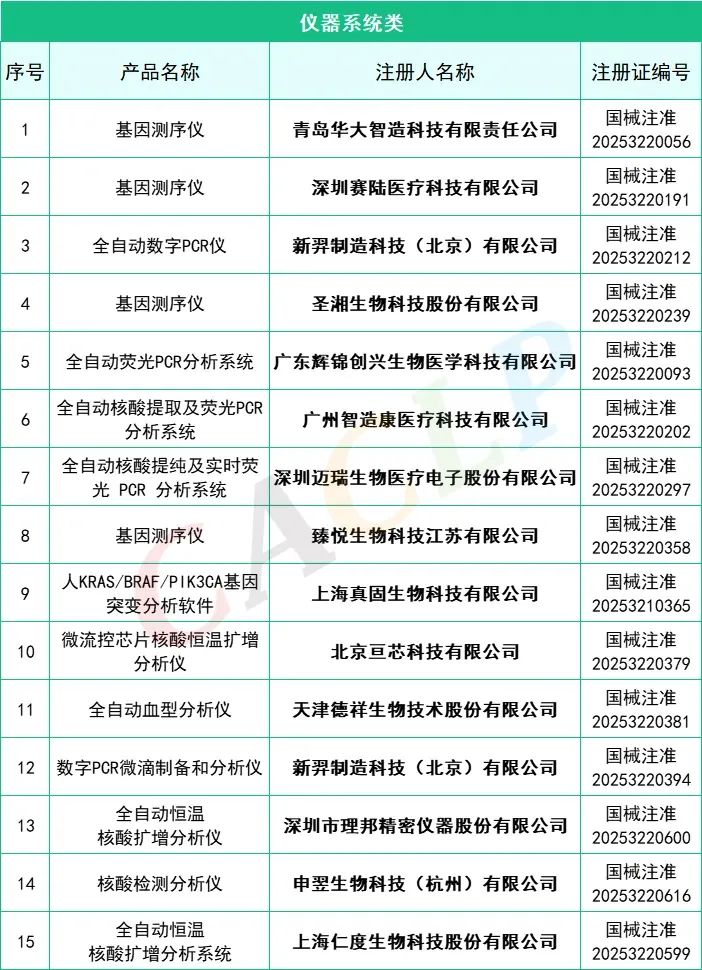
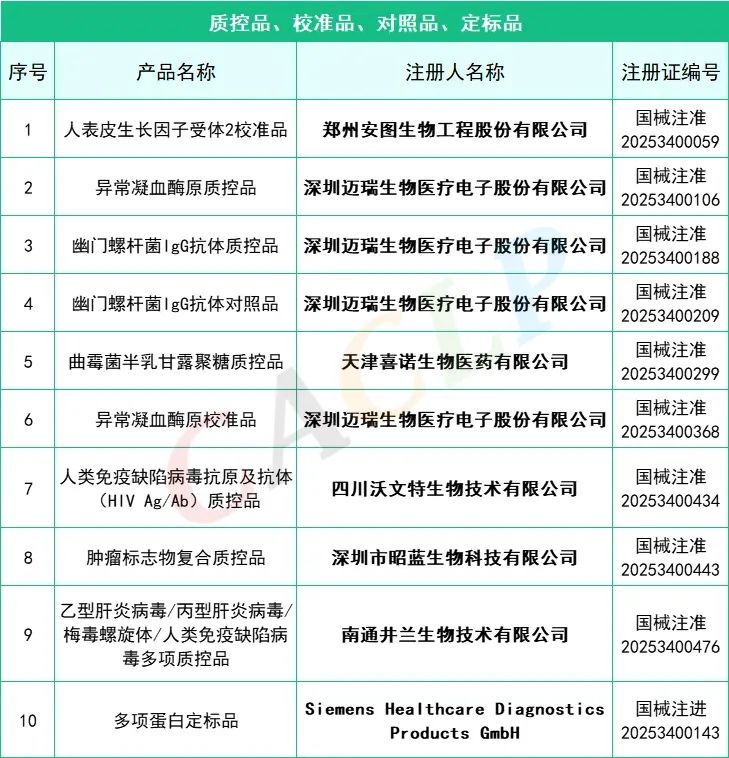
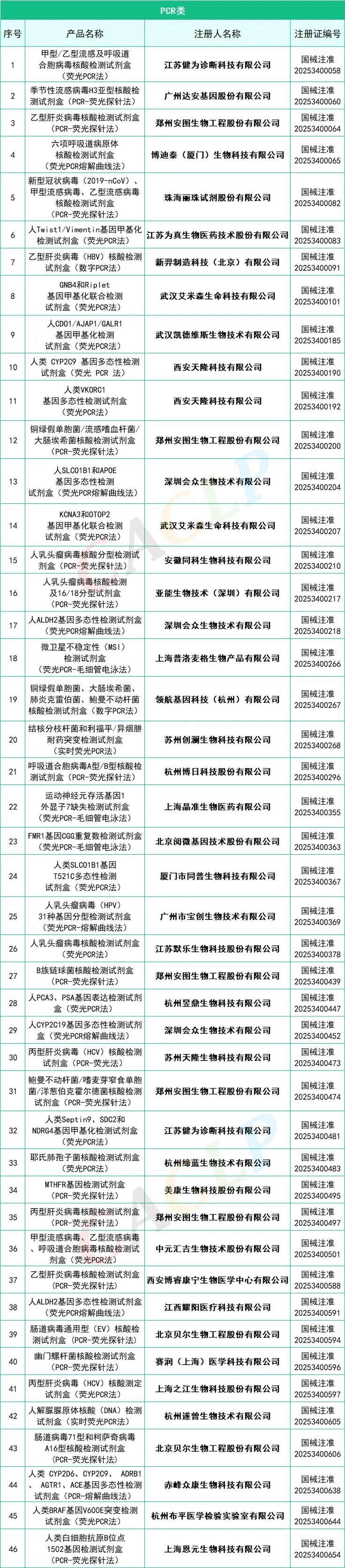
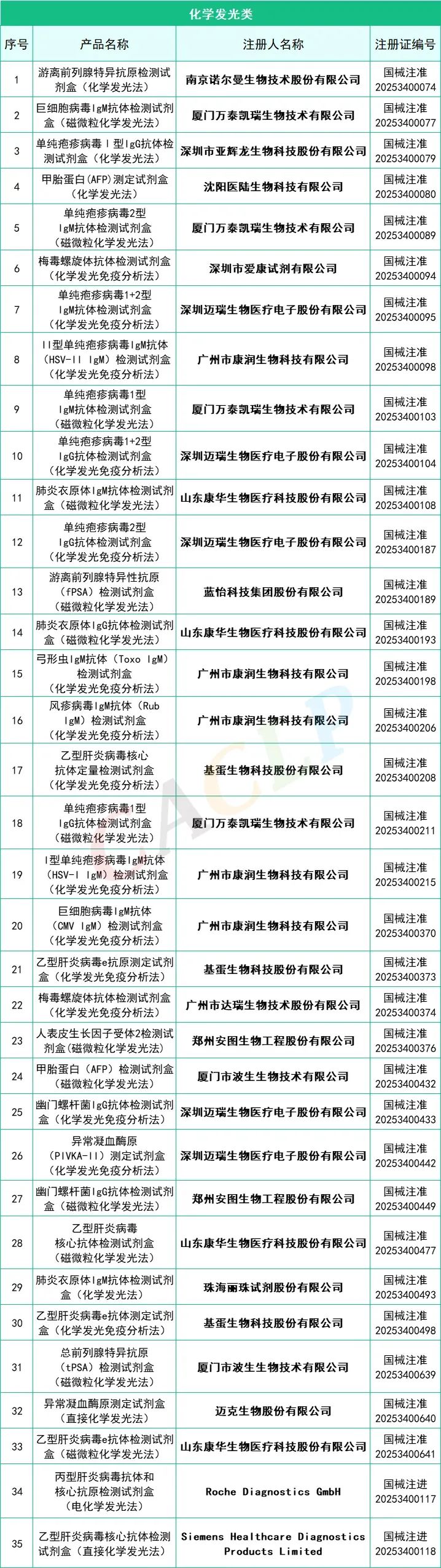
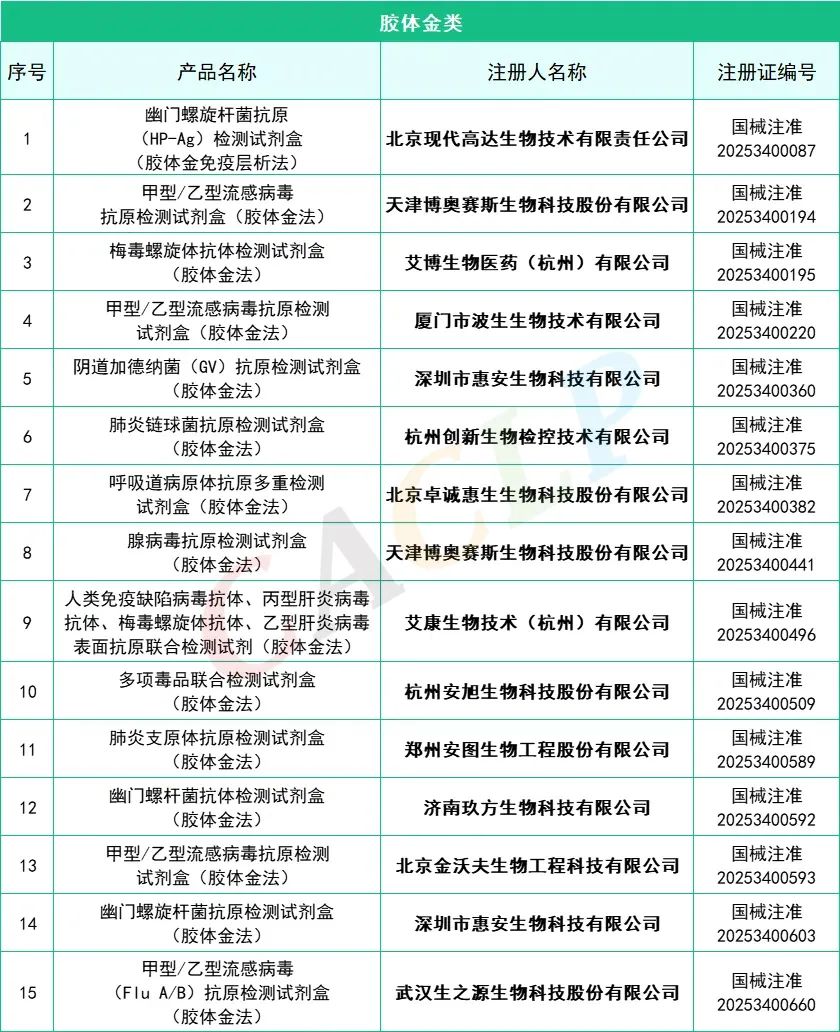
来源:CACLP

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

随着国家医疗改革的不断深入,使得综合性大中型医疗机构的中心实验室对自动化系统有了新的要求,为了简化检测流程,提高检测效率,保证数据准确度等,中心实验室对集中化诊断

润滑剂类产品在美国根据产品预期用途的不同主要分为人体润滑剂和患者润滑剂:其中,人体润滑剂主要成分为水、丙二醇、羟乙基纤维素、苯甲酸、卡波姆、氢氧化钠等,作用于生殖

在我国,体外诊断试剂(IVD)是指:可单独使用或与仪器、器具、设备或系统组合使用, 在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中, 用于对人体样

FDA于2020.12.11发布了关于简短(Abbreviated) 510(k)申请的相关产品指南,该指南是在遵守“基于安全有效性途径”这一前提下编制提出的。在这个框架下,申请人若计划使用安全有效性途径提交

以下对欧代、英代简单介绍,下期将针对欧洲注册、英国注册的要求推出详细的专题讲解,包括符合性声明、标签、文件等。"
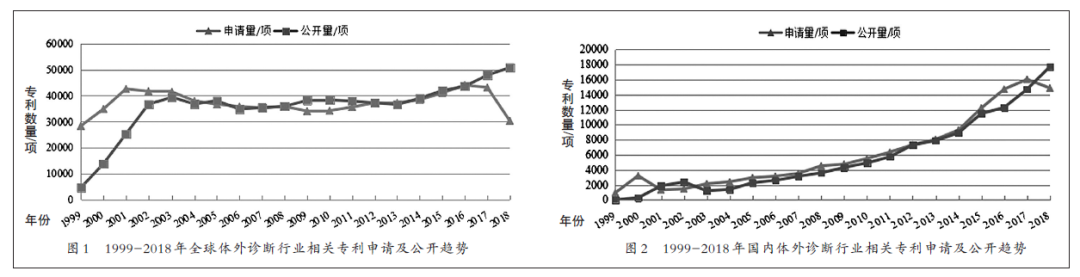
体外诊断(In Vitro Diagnosis,下称IVD),是在人体之外,通过对人体样本(血液、体液、组织等)进行检测而获取临床诊断信息,进而判断疾病或机体功能的产品和服务。IVD已经成为人类

日前,国家药监局发布《2018年度药品监管统计年报》(以下简称《统计年报》),该报告数据来源于《药品监督管理统计报表制度》,数据报告期为2017年12月1日至2018年11月30日。"

近日,莱博泰克(大连)科技有限公司成为我省医疗器械注册人制度试点以来首个获批注册品种的企业,其注册的第二类医疗器械“一次性咽喉手术支架”由大连澳华医用高分子器材有

2016年起,医疗机构对有冷链要求的体外诊断试剂实施了入库验收制度,要求供应商按照医院规定的时间将产品送到科室,必须由试剂管理部门验收人员、科室人员双方一起验收,验收要

国家药监局器审中心关于发布定性检测体外诊断试剂分析性能评估等6项医疗器械产品注册审查指导原则的通告(2022年第36号) 发布时间:2022-09-28 为进一步规范定性检测体外诊断试剂分析
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台