医疗器械临床试验具体流程(内含流程图)
医疗器械临床试验流程和管理体系来源于药物临床试验,但是医疗器械作用机理和研究方法与药物临床研究存在较大差异,医疗器械临床试验法规及研究、管理体系近几年逐步从药物临
来源:医疗器械注册代办 发布日期:2023-10-26 阅读量:次
现在参加临床试验的患者比起以前,数量增加了许多。但是就会有很多人担心临床试验安全不安全,临床试验受试者安全吗?这个问题就要从什么是临床试验开始说起。简单地说临床试验就是以人为对象之医学研究,因研究是要探讨目前尚未知或有争论之议题,因此临床试验之进行对受试者之安全可能有其潜在之风险,这些风险可能微乎其微,但也有可能具有很多未知之危险性(如使用新试验药或器材),受试者对试验内容及其风险之了解,医生(研究者)之解说与受试者知情同意书之内容是主要来源,事实上为了确保受试者之安全,所有临床试验必须经过国家食品药品监督管理局(CFDA)严格审查,所有审查委员均会以受试者之立场严格帮受试者把关。

只有试验本身对受试者之好处大于已知风险,或受试者之付出(如抽取适量之血液、身体检查)未具有危害健康之风险,且试验对医学进展确实有帮助时,该临床试验才有可能通过最终审查,此外由于隔行如隔山,为确保受试者可真正完全了解试验内容及其风险,伦理委员会要求同意书之书写必须浅显易懂,至少教育程度低者均可了解为原则,试验可能出现之已知副作用及可能之潜在风险必须详细写明于受试者知情同意书(受试者在参加试验前要仔细听医生给予解读,如有疑问可随时提出)。
由于临床试验之进行可能存有无法预料之风险,为确保受试者之安全,在国家食品药品监督管理局(CFDA)的监督管理下,由医院(机构)伦理对临床试验前期审核严格,并由稽查单位定期对临床试验项目安全执行及各项操作稽查,在临床试验项目进行中充分保护受试者的权益,如出现任何严重不良反应事件受试者可自行决定是否继续参加或退出临床试验,同时受试者会获得知情同意书中所规定的相应赔偿。
1、如果是药物,会影响人体。尤其是一些未知的药物治疗可能会对受试者的身体造成一定的伤害。
2、如果是新药,会有一定的未知风险。因此,除了必要的医学保证外,临床试验一般在大型医院进行,医学风险处理能力强,药物临床组织方也向受试者购买专业保险。
风险相较于药物来说,会小的很多。药物需要直接服用,而医疗器械大多作用于体表,就算有副作用,影响局部的概率大一些。
所以临床试验受试者安全吗?安全性只是相对的,也没有办法保证是完全安全的,毕竟药物也会有副作用。如果你有临床试验的需求或者您这边有需要临床医学的服务,可咨询我们思途医疗,这是一家完善的临床CRO类服务公司,立志于服务临床试验工作。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

医疗器械临床试验流程和管理体系来源于药物临床试验,但是医疗器械作用机理和研究方法与药物临床研究存在较大差异,医疗器械临床试验法规及研究、管理体系近几年逐步从药物临

思途近期将推出系类文章,为您科普医疗器械临床试验从开始到结束,及各阶段主要工作事项和要求。今天,先说说医疗器械临床试验准备阶段工作事项。"

临床试验是高风险及创新医疗器械上市许可进程中风险最高的环节之一,失败的医疗器械临床试验案例在医疗器械行业也是屡见不鲜。依据多年医疗器械临床试验及医疗器械注册经验,

在临床试验过程中,与受试者的有效沟通可以确保他们充分理解试验的目的、过程、风险和权利,同时也有助于维护试验的合法性和伦理性。CRC是与受试者的沟通至关重要的角色,所以CRC在与受试者沟通中应该掌握一些技巧:1、透明和清晰的信息传达:CRC应该提供清晰、简明的信息,确保受试者充分理解试验的目的、过程、预期风险和益处。使用非专业术语,以便受试者能够理解。2、咨询和问答:CRC应该鼓励受试者提出问题,并
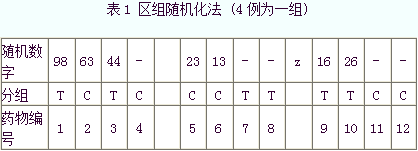
随机化是临床科研的重要方法和基本原则之一。在科研设计中,随机化方法包括两种形式。第一,随机抽样:指被研究的对象从被研究的目标人群中选出,借助于随机抽样的方法,使目
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台