长江三角洲区域医疗器械注册人制度试点工作实施方案(试行)(沪药监械管〔2019〕112号)
为深入贯彻落实中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),按照国家药品监督管理局《关于扩大医疗器械
来源:医疗器械注册代办 发布日期:2022-01-26 阅读量:次

发布时间:2022-01-26
根据《医疗器械监督管理条例》第七十六条规定,国家药监局审核批准《贴敷类医疗器械中17种化学药物识别及含量测定补充检验方法》,现予发布。
特此公告。
附件:贴敷类医疗器械中17种化学药物识别及含量测定补充检验方法.doc
国家药监局
2022年1月25日
本方法适用于以物理升温、物理退热、穴位压力刺激或者磁场作用等原理的贴敷类医疗器械。品名举例:远红外治疗贴、医用冷敷贴、医用退热贴、冷敷凝胶、磁疗贴、穴位压力刺激贴等。
本方法不适用于以铁粉氧化升温致热为工作原理的热疗贴、热灸贴等产品。
下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682 分析实验室用水规格和试验方法。
3.1本方法中的室温,如无特殊规定,应为10 ℃~30 ℃。
3.2本方法中试验用水应符合GB/T 6682的要求。
3.3本方法中所用容器如无特殊规定,应为硅硼酸盐玻璃容器。
3.4本方法中所涉及的量取,应使用符合相应国家标准规定的准确度要求的移液管量取。
4.1 概述
高效液相色谱仪的二极管阵列检测器(DAD)能够进行全波长扫描,灵敏度较高,且应用普遍、易于操作。高分辨的一级(MS)、二级质谱(MS2)数据能够给出更加准确可靠的结构信息。本方法采用高效液相色谱法(HPLC)进行初筛,高分辨液质联用法(HRMS/MS)或等效的液质联用法进行验证,验证后的阳性样品采用高效液相色谱法(HPLC)进行含量测定。
4.2 供试液的制备
取样品1贴,撕开不粘层,展开,贴在定量滤纸上,用剪刀裁去多余滤纸,然后将样品剪成0.5 cm×0.5 cm的小片,置于150 mL烧瓶中,加入甲醇适量将样品完全浸没,70 ℃回流两次,每次2 h。将浸提液转移至100 mL容量瓶中,用少量甲醇洗涤样品三次,合并洗涤液至容量瓶中,用甲醇定容至刻度,摇匀。取上述溶液经0.2 μm微孔滤膜过滤后作为供试液,必要时可进行适当倍数的稀释。
4.3高效液相色谱法
4.3.1 仪器与试剂
4.3.1.1 仪器
高效液相色谱仪,配有二极管阵列检测器。
4.3.1.2 试剂
a)甲醇:色谱纯,CAS# 67-56-1;
b)乙腈:色谱纯,CAS# 75-05-8;
c)磷酸:分析纯,CAS# 7664-38-2;
d)17种药物信息见表1。
表1 17种药物信息
| 编号 | 名称 | CAS号 | 分子式 |
| 1 | 氨基比林 | 58-15-1 | C13H17N3O |
| 2 | 甲氧苄啶 | 738-70-5 | C14H18N4O3 |
| 3 | 对乙酰氨基酚 | 103-90-2 | C8H9NO2 |
| 4 | 泼尼松 | 53-03-2 | C21H26O5 |
| 5 | 氢化可的松 | 50-23-7 | C21H30O5 |
| 6 | 地塞米松 | 50-02-2 | C22H29FO5 |
| 7 | 水杨酸甲酯 | 119-36-8 | C8H8O3 |
| 8 | 醋酸泼尼松 | 125-10-0 | C23H28O6 |
| 9 | 醋酸可的松 | 50-04-4 | C23H30O6 |
| 10 | 酮洛芬 | 22171-81-5 | C16H14O3 |
| 11 | 萘普生 | 22204-53-1 | C14H14O3 |
| 12 | 醋酸地塞米松 | 1177-87-3 | C24H31FO6 |
| 13 | 保泰松 | 50-33-9 | C19H20N2O2 |
| 14 | 氟比洛芬 | 5104-49-4 | C15H13FO2 |
| 15 | 布洛芬 | 15687-27-1 | C13H18O2 |
| 16 | 吲哚美辛 | 53-86-1 | C19H17ClNO4 |
| 17 | 双氯芬酸钠 | 15307-79-6 | C14H10Cl2NNaO2 |
4.3.2药物对照品储备溶液的配制
分别取4.3.1.2中17种药物对照品各约10 mg,精密称定,置10 mL棕色容量瓶中,加入甲醇溶解后定容,摇匀,配制成浓度为1 mg/mL的药物对照品储备溶液。
4.3.3高效液相色谱条件(推荐)
4.3.3.1色谱柱:XBridge BEH Shield RP18 2.5 μm 4.6×150 mm,或其他等效色谱柱。
4.3.3.2柱温:35 ℃,样品室温度:10 ℃;
4.3.3.3流速:1 mL/min;
4.3.3.4检测波长:220 nm,扫描范围:190 nm~400 nm;
4.3.3.5进样量:10 μL。
4.3.3.6流动相:A(pH 3.0的磷酸水溶液)B(甲醇:乙腈 1:1),梯度条件见表2。
表2 HPLC法流动相梯度条件
| 时间(min) | A(%) | B(%) |
| 0 | 94 | 6 |
| 8 | 45 | 55 |
| 20 | 45 | 55 |
| 25 | 10 | 90 |
| 26 | 10 | 90 |
| 26.5 | 94 | 6 |
| 30 | 94 | 6 |
4.3.4系统适应性试验
4.3.4.1 分离度
取4.3.2中17种药物对照品储备溶液各0.1 mL于10 mL容量瓶中,加甲醇稀释至刻度,制成浓度为10 mg/L的混合对照溶液,取10 μL注入液相色谱仪,记录色谱图,17种对照品的色谱峰与相邻色谱峰之间的分离度应大于1.5。
4.3.4.2 灵敏度
取4.3.2中17种药物对照品储备溶液适量,分别用甲醇稀释至表3中“检出限(LOD)”的浓度,取10 μL注入液相色谱仪,记录色谱图,17种对照品的色谱峰信噪比(S/N)均应大于3:1。
表3 17种药物灵敏度要求
| 编号 | 名称 | 检出限LOD (mg/L) |
| 1 | 氨基比林 | 1.5 |
| 2 | 甲氧苄啶 | 0.2 |
| 3 | 对乙酰氨基酚 | 0.2 |
| 4 | 泼尼松 | 0.2 |
| 5 | 氢化可的松 | 0.2 |
| 6 | 地塞米松 | 0.2 |
| 7 | 水杨酸甲酯 | 0.5 |
| 8 | 醋酸泼尼松 | 0.5 |
| 9 | 醋酸可的松 | 0.5 |
| 10 | 酮洛芬 | 0.2 |
| 11 | 萘普生 | 0.05 |
| 12 | 醋酸地塞米松 | 0.5 |
| 13 | 保泰松 | 0.5 |
| 14 | 氟比洛芬 | 0.5 |
| 15 | 布洛芬 | 0.5 |
| 16 | 吲哚美辛 | 0.5 |
| 17 | 双氯芬酸钠 | 0.2 |
4.4高分辨液质联用法
4.4.1 仪器与试剂
4.4.1.1 仪器
高分辨液质联用仪
4.4.1.2 试剂
a)甲醇:质谱纯,CAS# 67-56-1;
b)乙酸铵:质谱纯,CAS# 631-61-8;
c)17种药物对照品同4.3.1.2 d)。
4.4.2对照品溶液配制
同4.3.4.1中浓度为10 mg/L的混合对照溶液配制。
4.4.3色谱条件(示例)
4.4.3.1色谱柱:Hypersil Gold 100×2.1 mm 1.9 μm,或其他等效色谱柱。
4.4.3.2 柱温:40 ℃,样品室温度:10 ℃;
4.4.3.3 流速:0.2 mL/min;
4.4.3.4 检测波长:220 nm;
4.4.3.5进样量:2 μL。
4.4.3.6 流动相:A(10 mmol/L乙酸铵的水溶液)B(甲醇),梯度条件见表4。
表4 HPLC-HRMS/MS法流动相梯度条件
| 时间(min) | A (%) | B (%) |
| 0 | 90 | 10 |
| 1 | 90 | 10 |
| 7 | 5 | 95 |
| 11 | 5 | 95 |
| 12 | 90 | 10 |
| 15 | 90 | 10 |
4.4.4质谱条件(示例)
4.4.4.1 仪器型号:Themo Q-Exactive Focus型高分辨液质联用仪。
4.4.4.2 离子源:ESI 扫描模式:正负切换;
4.4.4.3 鞘气:30 arb 辅助气:8 arb 吹扫气:0 arb;
4.4.4.4 电喷雾电压:3.0 kV;
4.4.4.5 毛细管温度:320 ℃;
4.4.4.6 传输透镜电压:55.0 %;
4.4.4.7 辅助气加热温度:300 ℃;
4.4.4.8 17种药物测定参数见表5。
表5 17种药物检测模式、二级能量及碎片离子
| 编号 | 名称 | 检测 模式 | m/z | 碎片信息 | 能量(NCE) |
| 1 | 氨基比林 | ﹢ | 232.1444 | 113*,139,187,217 | 20 |
| 2 | 甲氧苄啶 | ﹢ | 291.1452 | 123*,201,245,261,275 | 50 |
| 3 | 对乙酰氨基酚 | ﹢ | 152.0706 | 65,92,110*,134 | 50 |
| 4 | 泼尼松 | ﹢ | 359.1853 | 147*,237,313,341 | 25 |
| 5 | 氢化可的松 | ﹢ | 363.2176 | 97,121*,173,267,309,327,345 | 25 |
| 6 | 地塞米松 | + | 393.2072 | 147,237,319,337,355*,373 | 15 |
| 7 | 水杨酸甲酯 | ﹣ | 151.0390 | 75,91*,93,119,121 | 60 |
| 8 | 醋酸泼尼松 | ﹢ | 401.1959 | 147,237,295*,313,341,383 | 18 |
| 9 | 醋酸可的松 | ﹢ | 403.2115 | 101,163 *,325,343,361 | 25 |
| 10 | 酮洛芬 | ﹢ | 255.1017 | 105,177,209* | 21 |
| 11 | 萘普生 | ﹢ | 231.1017 | 170,185* | 20 |
| 12 | 醋酸地塞米松 | ﹢ | 435.2177 | 147,237,309,397*,415 | 15 |
| 13 | 保泰松 | ﹢ | 309.1598 | 120,146,160 *,211 | 35 |
| 14 | 氟比洛芬 | - | 243.0817 | 199* | 20 |
| 15 | 布洛芬 | ﹣ | 205.1223 | 159* | 10 |
| 16 | 吲哚美辛 | ﹣ | 356.0684 | 111,297,312* | 10 |
| 17 | 双氯芬酸钠 | ﹣ | 294.0094 | 250* | 10 |
注:*为基峰
4.5药物识别及其含量测定
取4.2制备的供试液及4.3.4.1制备的10 mg/L的混合对照溶液,按照4.3.3的方法进样分析。将二者结果进行对比,以保留时间(tR)及190 nm~400 nm的紫外光谱图一致性作为初筛依据。
取可能含有药物的供试液及相应药物对照品溶液,按照4.4.3、4.4.4的方法进样分析。将供试液与对照品溶液的母离子及碎片离子信息进行对比,二者一致则确认该样品中含有相应的药物成分。
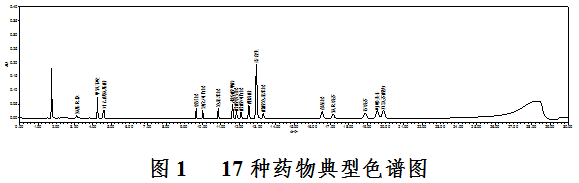
取4.3.2中阳性样品中所含药物的对照品储备溶液,配制成系列浓度的标准溶液,按照4.3.3的方法进样分析。绘制浓度-峰面积标准曲线,根据峰面积计算样品中药物的量。图1给出了17种药物的典型色谱图。
4.6其他药物识别方法
本方法中给出了17种药物的识别和含量测定方法,如关注其他可能添加的药物,也可采用经方法学验证的方法进行分析。
供试液中不得检出上述17种药物成分(检出限见表3)。
起草单位:山东省医疗器械和药品包装检验研究院
复核单位:深圳市药品检验研究院
安徽省食品药品检验研究院

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

为深入贯彻落实中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),按照国家药品监督管理局《关于扩大医疗器械

关于发布医疗器械质量管理体系年度自查报告编写指南的通告(2022年第13号)发布时间:2022-03-24为加强医疗器械生产监管,保障医疗器械安全有效,根据《医

附件:一次性使用医用冲洗器产品注册审查指导原则(2022年第41号).doc一次性使用医用冲洗器产品注册审查指导原则本指导原则旨在指导注册申请人对一次性使用医用

为深化医疗器械审评审批制度改革,加强医疗器械临床试验管理,根据《医疗器械监督管理条例》(国务院令第739号)及《医疗器械注册与备案管理办法》(市场监管总局令第47号)、《

附件:中医熏蒸治疗设备注册审查指导原则(2022年第43号).doc中医熏蒸治疗设备注册审查指导原则本指导原则旨在指导注册申请人对中医熏蒸治疗设备注册申报资料的

附件:医疗器械生产监督管理办法(国家市场监督管理总局令2022年第53号).doc医疗器械生产监督管理办法(2022年3月10日国家市场监督管理总局令第53号公布自2022年5月1日起施行)第一章总则第一条为了加强医疗器械生产监督管理,规范医疗器械生产活动,保证医疗器械安全、有效,根据《医疗器械监督管理条例》,制定本办法。第二条在中华人民共和国境内从事医疗器械生产活动及其监督管理,应当遵守本办法。

附件:无托槽矫治器注册审查指导原则(2022年第41号).doc无托槽矫治器注册审查指导原则本指导原则旨在指导注册申请人对无托槽矫治器注册申报资料的准备及撰写,

为提高医疗器械技术审评的规范性和科学性,指导医疗器械注册人/备案人编写产品技术要求,根据《医疗器械监督管理条例》及《医疗器械注册与备案管理办法》《体外诊断试剂注册与

附件: 医用中心供氧系统注册审查指导原则(2022年第35号).doc 医用中心供氧系统注册审查指导原则 本指导原则旨在指导注册申请人对医用中心供氧系统注册申报资料的准备及撰写,同

附件:一次性使用末梢采血针产品注册审查指导原则(2022年第41号).doc一次性使用末梢采血针产品注册审查指导原则本指导原则旨在指导注册申请人对一次性使用末梢
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台