干货|临床SSU工作内容和具体工作流程
SSU是Study Start Up的缩写,从最初的项目准备,到启动访视(Site Initiation Visit)之前所有的准备工作,对整个临床研究项目的启动非常关键。负责这个关键阶段工作的部门人员,就叫做SS
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
GMP是指生产质量体系运行认证,是药监体系核查部门对该厂设备环境是否满足生产该类产品的硬性条件考察项之一。简单来说,生产车间管理人员质量管控水平和运维人员素质都需要提高,在符合ISO13485的条件下合规化生产。实施GMP有利于办理医疗器械产品注册证和生产许可证。眼光放远,有利于提高企业和产品的声誉,提高竞争力。对于企业管理人员来说,有利于提高科学的管理水平,促进企业人员素质提高和增强质量意识,保证产品质量。对于消费者来说,有利于保证消费者权益,确保产品质量安全。
通常情况下,一个生产企业配备1-2名体系专员(管代)。体系文件及记录文件均由GMP专员编写,客户公司人员不了解相关知识及信息,无法应对体系考核老师的提问,造成无法顺利通过体系考核。有些管代因入行未深、学习GMP知识认知过浅等原因,通过体系考核后不能正常运行质量管理体系,无法在GMP要求下管理公司及应对飞检,造成飞检不通过而关厂。GMP专员投入精力和时间过多,众所周知,多个产品GMP需同时多个条件,无法兼顾多个项目,易造成客户不满意,从而增加公司运行成本。尤其对于初创企业而言,资金储备量低、资金链断裂等问题都有可能变成灭顶之灾。

gmp年度培训计划就是在这个基础上孕育而生,近些年,随着药监管理部门加大飞检力度,企业对GMP生产质量体系更加重视,但也常遇见轻如停业整改,重如停产的惩罚。
GMP服务的重点在于辅导、培训、答疑解惑。主要涵盖6大项:
(1)编写质量管理体系文件(通用文件):主要有受控文件清单和质量记录模板清单等。
(2)指导客户编写技术文件(产品专用文件)。
(3)指导客户准备GMP认证所需资料(如下图)。
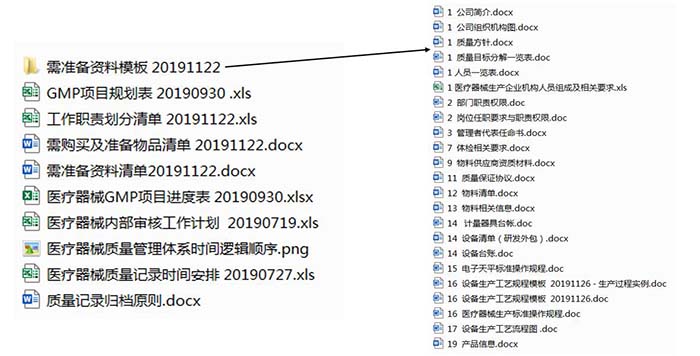


据我们了解,某企再给生产企业做GMP年度辅导时只是简单培训加盖章,可以说是极度不负责。年度辅导的工作量不亚于企业新办GMP体系,没有GMP体系文件的企业,套用模板加真实情况结合。已有GMP体系文件的企业,需要一条一条的核查,挑出毛病并修改,需要投入更大时间及精力,项目周期会加长。有些公司GMP辅导收费1万,有的收费5万各有各的理由,请注意小心被套路。思途对客户负责,也对金字招牌负责。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

SSU是Study Start Up的缩写,从最初的项目准备,到启动访视(Site Initiation Visit)之前所有的准备工作,对整个临床研究项目的启动非常关键。负责这个关键阶段工作的部门人员,就叫做SS

在临床试验中,无论是监查员、质控人员或者项目管理人员到研究中心查看项目资料的时候,总会多多少少发现一些问题,有些问题可能大家都比较熟知,但处理手法五花八门的。处理

临床试验从筛选到立项、启动、入组和中心关闭是一个完整的闭环,什么时候可以开始关闭中心?关闭中心需要做哪些事情?从哪里着手?今天我们就来谈一谈临床试验关中心阶段的那

脱落是每个临床试验中都会出现并且也最让人头痛的现象。但是是什么原因引起脱落而我们怎么才能减少脱落呢?那么我们来谈一下,项目中常见的脱落问题,希望能为各位项目人员提

俗话说“知己知彼,百战不殆”,对于作为CRC的我们,自认为对CRA其实已经很了解了,但是在我们工作过程有一个角色平时接触不到,但是却又绕不开躲不过,尤其是面对满屏EDC query的

关中心访视(Close Out Visits,简称COV),想必大家都听说过。作为临床试验最后一个阶段,COV也是非常重要的一个环节,今天和大家分享一下作为监查员在COV时应该做哪些工作。什么时候

在临床试验方案的设计过程中,大家都会尽可能的考虑到各种可能影响试验的因素,并制定标准操作规程,尽量避免和减少在试验中可能出现违背及偏离方案的情况发生,但在试验的执

gmp、GLP和GCP是什么?gmp(GOOD MANUFACTURING PRACTICE)良好生产规范:世界卫生组织将gmp定义为指导食物、药品、医疗产品生产和质量管理的法规。gmp要求制药、食品等生产企业应具备良好的

我国《药品注册管理办法》规定临床试验分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期,其中Ⅰ、Ⅱ、Ⅲ临床试验在药品上市前进行,而Ⅳ期临床试验是新药临床试验的一个重要组成部分,是对新药上市前Ⅰ

招募广告是临床试验中用以招募受试者的一种方法,随着药物、器械临床试验以及研究者发起的涉及人的生物医学研究越来越广泛地开展,临床试验中招募广告的使用也日益频繁,甚至
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台