有源医疗器械加速老化试验效期验证及使用期限验证流程
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有
来源:医疗器械注册代办 发布日期:2024-04-03 阅读量:次


































声明:本文章为网络转载,所转载文章内容及版权均归原作者所有,如涉及侵权,请与我联系处理。如带来不便,敬请谅解!

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
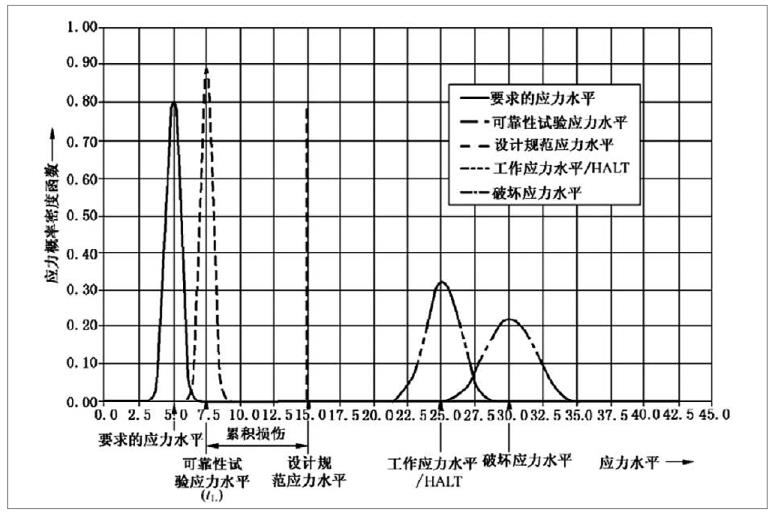
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有

简述了中药新药临床试验主要特点,指出要重视风险、受益评估,重视人 用经验选择科学、客观、合适的有效性指标,做好中医证候疗效评价,鼓励在中药新药临床研究中采用电子化手

按照中共中央办公厅和国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)和《国务院关于修改〈医疗器械监督管理条例〉的决定》(

体外诊断试剂临床试验数据造假行为,怎么处罚?本文针对体外诊断试剂注册环节的临床试验数据造假行为,一起来看看惩罚力度。

为进一步规范体外诊断试剂的管理,国家药监局器审中心组织制定了《人类SDC2基因甲基化检测试剂临床试验资料技术审评要点》、《异常凝血酶原测定试剂临床试验资料技术审评要点》

国家药监局器审中心关于发布定性检测体外诊断试剂分析性能评估等6项医疗器械产品注册审查指导原则的通告(2022年第36号) 发布时间:2022-09-28 为进一步规范定性检测体外诊断试剂分析

随着医疗器械分类及免临床医疗器械目录的调整,部分电子内窥镜产品的管理类别从III调整为II类,同时列入免于进行临床试验的医疗器械目录,因此在注册申报过程中,其注册申报要求

江苏省2021年医疗器械临床试验监督抽查项目 序号 备案号 试验用医疗器械名称 申办者 临床试验机构 1 苏械临备20190008 连续血糖监测系统 南通九诺医疗科技有限公司 南京大学医学院附
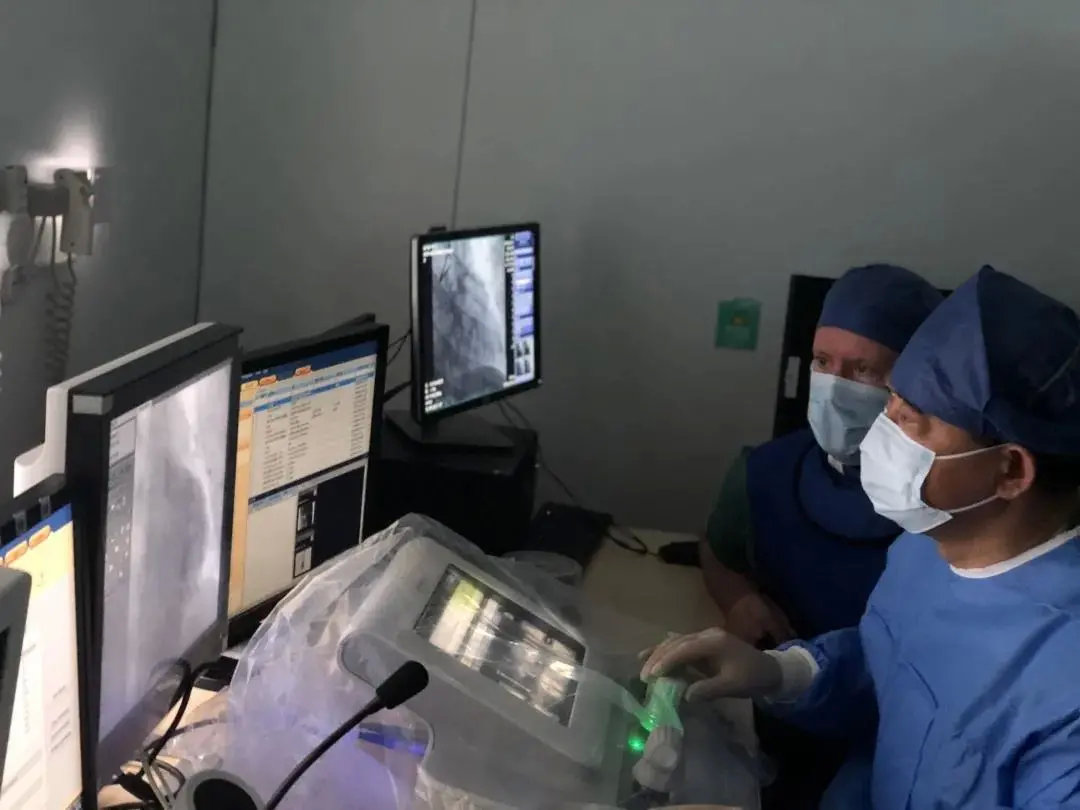
3月13日,西门子医疗Corindus途灵™最新一代CorPath®GRX介入手术机器人在海南博鳌超级医院完成其国内首例机器人辅助下冠状动脉介入治疗(PCI)手术,手术由中国科学院院士、复旦大学附
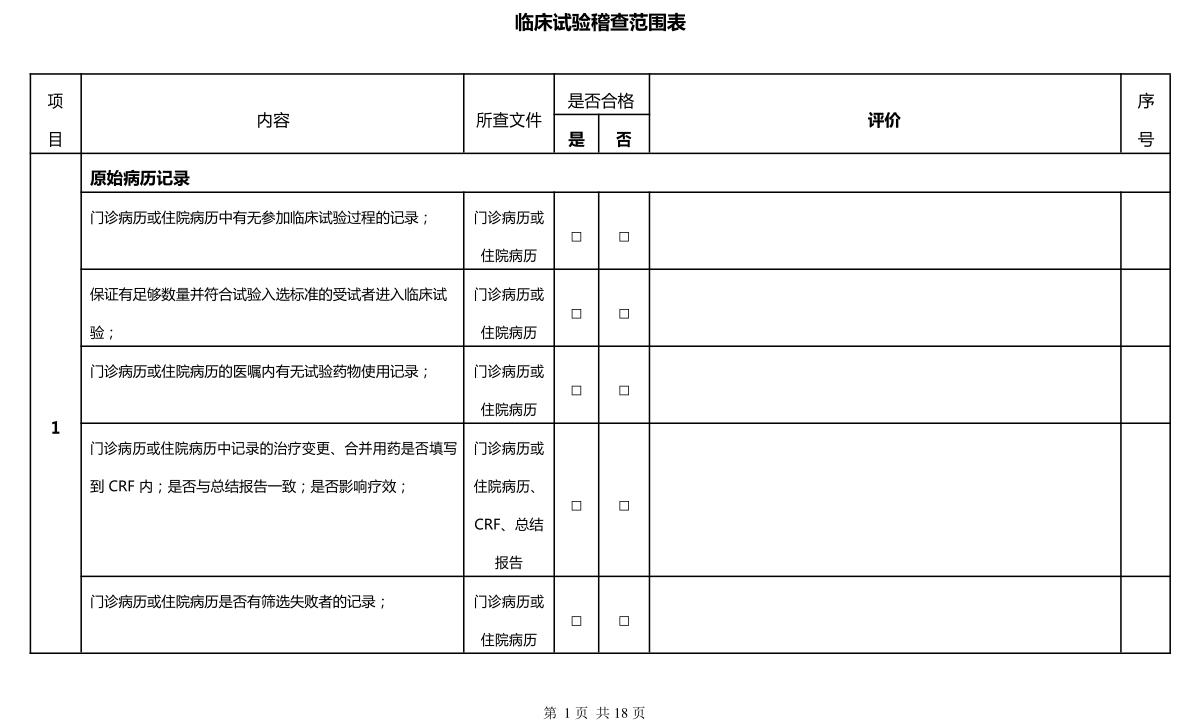
临床试验第三方稽查公司不少,思途就是其中之一。在稽查时,相关人员要明确稽查范围,让临床试验更真实化、合规化。本文将思途在给客户做稽查时的稽查表分享出来,文末供下载
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台