体外诊断试剂ivd的贮存条件和运输要求
在我国,体外诊断试剂(IVD)是指:可单独使用或与仪器、器具、设备或系统组合使用, 在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中, 用于对人体样
来源:医疗器械注册代办 发布日期:2024-01-04 阅读量:次

发布时间:2024-01-03
为加强医疗器械注册申报和技术审评指导,国家药监局器审中心组织制修定了《体外诊断试剂主要原材料研究注册审查指导原则》等12项注册审查指导原则,现予发布。
特此通告。
附件:1.体外诊断试剂主要原材料研究注册审查指导原则(下载)
2.布鲁氏菌 IgM/IgG 抗体检测试剂注册审查指导原则(下载)
3.丙型肝炎病毒抗体检测试剂注册审查指导原则(下载)
4.寨卡病毒核酸检测试剂注册审查指导原则(下载)
5.曲霉核酸检测试剂注册审查指导原则(下载)
6.自测用血糖监测系统注册审查指导原则(2023年修订版)(下载)
7.体外诊断试剂说明书编写指导原则(2023年修订版)(下载)
8.肿瘤标志物类定量检测试剂注册审查指导原则(2023年修订版)(下载)
9.流行性感冒病毒核酸检测试剂注册审查指导原则(2023年修订版)(下载)
10.流行性感冒病毒抗原检测试剂注册审查指导原则(2023年修订版)(下载)
11.病原体特异性M型免疫球蛋白定性检测试剂注册审查指导原则(2023年修订版)(下载)
12.乙型肝炎病毒脱氧核糖核酸检测试剂注册审查指导原则(2023年修订版)(下载)
国家药品监督管理局
医疗器械技术审评中心
2024年1月2日

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

在我国,体外诊断试剂(IVD)是指:可单独使用或与仪器、器具、设备或系统组合使用, 在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中, 用于对人体样

近日美国食品药品监督管理局(FDA)更新了《医疗器械提交的反馈申请和会议申请:Q-Submission指导原则》。此文件是对2019版Q-sub指导原则的更新,更新的主要内容如下:1. 增加了STeP医疗

体外诊断试剂临床试验数据造假行为,怎么处罚?本文针对体外诊断试剂注册环节的临床试验数据造假行为,一起来看看惩罚力度。
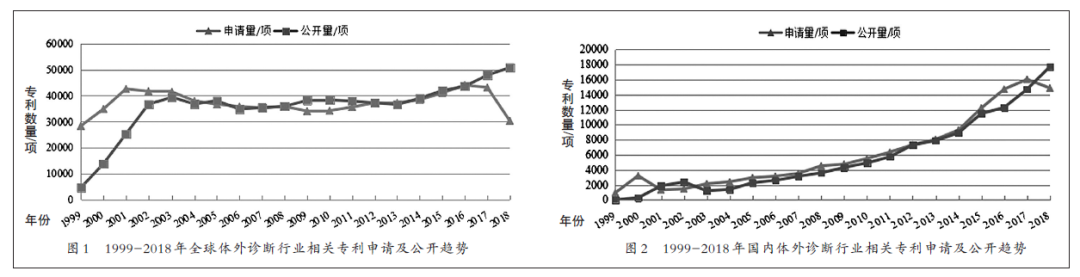
体外诊断(In Vitro Diagnosis,下称IVD),是在人体之外,通过对人体样本(血液、体液、组织等)进行检测而获取临床诊断信息,进而判断疾病或机体功能的产品和服务。IVD已经成为人类

2016年起,医疗机构对有冷链要求的体外诊断试剂实施了入库验收制度,要求供应商按照医院规定的时间将产品送到科室,必须由试剂管理部门验收人员、科室人员双方一起验收,验收要

国家药监局器审中心关于发布定性检测体外诊断试剂分析性能评估等6项医疗器械产品注册审查指导原则的通告(2022年第36号) 发布时间:2022-09-28 为进一步规范定性检测体外诊断试剂分析

为进一步规范体外诊断试剂的管理,国家药监局器审中心组织制定了《人类SDC2基因甲基化检测试剂临床试验资料技术审评要点》、《异常凝血酶原测定试剂临床试验资料技术审评要点》
思途给大家提供免于医疗器械注册质量管理体系核查相关说明的全文内容和文档下载,如果您有免于医疗器械注册质量管理体系核查相关说明的相关临床需求请及时找思途,关注思途了

为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了《关节镜下无源手术器械产品注册审查指导原则》《一次性使用输尿管导引鞘注
为贯彻落实省委省政府关于鼓励支持医疗器械研究与创新的决策部署,加快创新医疗器械上市审批,促进新技术的推广和应用,推动医疗器械产业高质量发展,江苏省药品监督管理局决
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台