药物临床试验机构备案要求及常见问题分析
2019-12-01药物临床试验机构(简称机构)开始实行备案管理。本文结合机构备案平台构建思路,着重介绍了备案平台的结构组成以及相关要求,梳理了机构备案过程中的常见问题,对机构
来源:医疗器械注册代办 发布日期:2024-11-07 阅读量:次
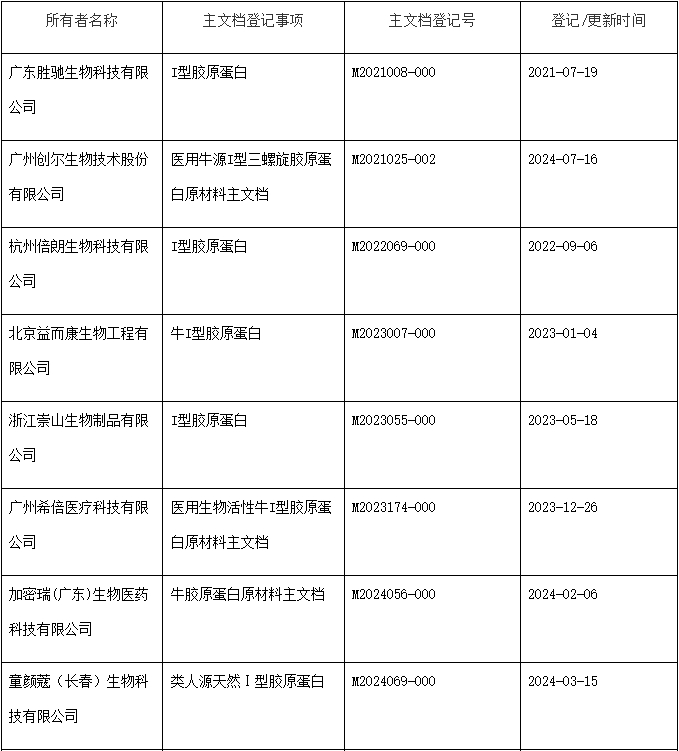
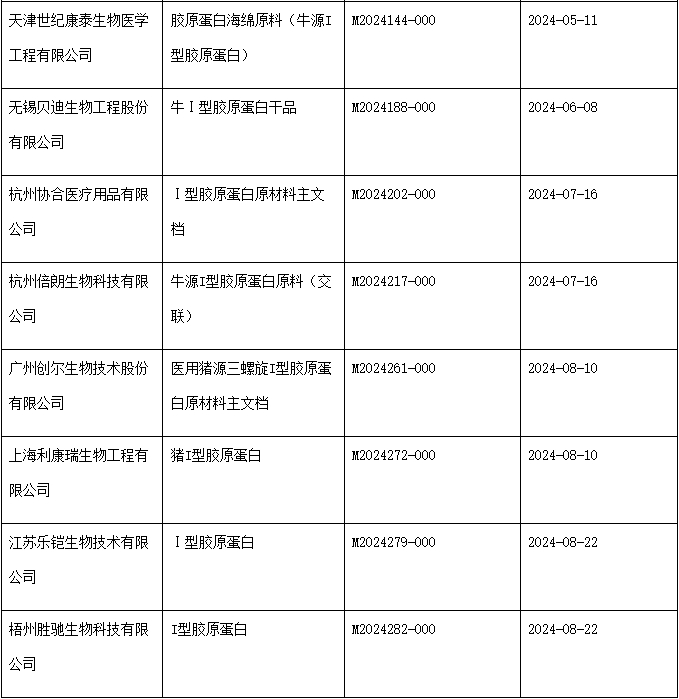
动物源胶原蛋白常用于医美类产品,例如胶原贴敷料和整形用注射填充物。胶原贴敷料主要用于皮肤激光术后创面修复的辅助治疗,整形用注射填充物主要用于纠正鼻唇沟纹和额部动力性皱纹。动物源胶原蛋白作为医疗器械产品原材料,可以进行主文档登记,用于授权医疗器械注册申请人在申报医疗器械注册等事项时引用其作为注册申报资料的一部分。
动物组织提取是胶原蛋白的主要来源之一。动物来源的胶原,比如猪源I型胶原蛋白、牛源I型胶原蛋白等,具有稳定的三螺旋结构,生物活性强,能够起到较强的支撑作用。
但对于人体来说,动物源的胶原属于异体胶原蛋白,可能携带具有传染性的病原体,产生异体排斥反应。因此在注册资料中应提交关于动物源性材料病原体灭活工艺的研究资料及降低免疫源性物质的工艺研究资料。供应商可将此部分资料进行主文档登记。
医疗器械原材料(体外诊断试剂除外)的技术资料一般是指原材料组成成分描述、理化性能研究资料、生物学评价资料、毒理学风险分析资料等。
采用的胶原蛋白原料,应符合ASTM F2212—2009的要求。考虑到原料来自于动物, 会产生携带病毒的风险,应参照YY/T 0771.1、YY/T 0771.2、YY/T 0771.3进行管理。
生物学功能:动物源胶原蛋白主要生物学功能是为细胞提供支架和良好的微环境,可通过评价细胞-胶原蛋白相互作用来评价动物源胶原蛋白的生物学功能,比如细胞增殖、细胞分化、细胞粘附性、细胞的迁移或移行。
生物学评价:应按照GB/T 16886.1 的要求对动物源胶原蛋白进行相应必要的生物学评价。应在材料的化学表征、毒代动力学和有关毒性风险评价的科学数据基础上进行毒理学评价。如有必要,还应该基于详细测试并获得数据后再进行毒理学评价。评价包括短期和长期的潜在影响,包括细胞毒性、刺激反应、致敏性、热原、遗传毒性、皮下植入、免疫原性、全身毒性和致癌性。
包装、运输和贮存:建议考虑相关医疗器械产品对原材料包装、贮存、运输的要求。
动物源胶原蛋白的性能指标如下(仅供参考):
1)理化特性
可研究外观、可见异物、溶解性、水分灼烧残渣、PH值、渗透压摩尔浓度、动力粘度、热稳定性、装量及其差异、熔点。
2)鉴别
可研究肽图、末端氨基酸序列、分子量、等电位。
3)纯度
可通过电泳法或高效液相色谱法进行试验。
4)杂质、污染物和添加剂
杂质检测项目可能涉及到的项目有:杂蛋白分析、外源性DNA残留量、残余抗生素含量/活性、促炎性污染物(肽聚糖等)、重金属及微量元素含量、添加剂等。
5)含量
可用总蛋白含量和纯度计算。
6)结构表征
可通过特异性分析、一级结构的表征、红外光谱、圆二色光谱、微量差热分析、蛋白酶敏感性分析、脯氨酸羟基化分析、糖基化修饰分析进行研究。
7)安全性试验
无菌、细菌内毒素、微生物限度等。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

2019-12-01药物临床试验机构(简称机构)开始实行备案管理。本文结合机构备案平台构建思路,着重介绍了备案平台的结构组成以及相关要求,梳理了机构备案过程中的常见问题,对机构

医疗器械临床试验与药物临床试验在研究方法、统计方法、法规、程序等方面相近。药物的致效机理基本相同,医疗器械的作用机理千差万别,因此,医疗器械临床试验与药物临床试验

知情同意,指受试者被告知可影响其做出参加临床试验决定的各方面情况后,确认同意自愿参加临床试验的过程。改过程应当以书面的、签署姓名和日期的知情同意书作为文件证明。对

90%的人忽略了女性CRA晋升到PM/LM/QM的难度,因为身体差异和社会歧视等因素,很多女性CRA晋升到manager的途径其实是比较有限的,因此需要做好人生规划和职业规划才行。

为提高医疗器械临床试验的方案依从性,保证临床试验的质量,对涉及人的生物医学研究过程中不依从/违背或偏离方案伦理审查中存在的问题进行分析,并提出解决措施。"

根据《医疗器械监督管理条例》的规定,申请第二类、第三类医疗器械产品注册,应当提交临床评价资料,虽然《医疗器械监督管理条例修正案(草案送审稿)》(以下简称《修正案》)中提及

医疗器械临床试验是初步的临床人体安全、有效性的评价试验。随着科技的飞速发展,医疗器械的研发逐年增多,提高医疗器械临床研究水平显得更加重要。医疗器械的门类、功效非常

在临床试验中扮演着”大管家”这个角色的CRC,将越发举足轻重。一个专业的CRC能协助研究者、申办方有效高效地完成临床试验,作为一名合格的CRC,不仅要专业知识扎实,逻辑思维好

前两天,客户留言“两个单中心试验纳排标准相同,数据能否合并分析?”看到这个问题我是一脸懵逼,赶紧咨询临床试验中心同事,我的疑问在于:什么是单中心试验?两个单中心试

根据医疗器械审评要求,医疗器械产品在注册申报时需要进行各项研究,如材料的化学表征、稳定性、工艺研究等。而在进行医疗器械产品研究时,部分项目特别是材料的化学表征与原
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台