医疗器械注册证信息怎么查询?
医疗器械注册证是依照法定程序,对拟上市销售、使用的医疗器械的安全性、有效性进行评价,决定同意其销售、使用后发放的证件,由国家食品药品监督管理总局统一制定。"
来源:医疗器械注册代办 发布日期:2024-09-29 阅读量:次
开展药物临床试验必须提供临床试验用药物的药检报告;同样,医疗器械临床试验中产品检验报告也是不可或缺的。只有检验合格,方可开展临床试验或者申请注册、进行备案。在医疗器械临床试验日常管理工作中,我们发现申办方提供的产品检验报告除了规定的注册检验外,还常见委托检验、自检报告等多种形式。

下面我们详细介绍下三种类型产品检验报告。
注册检验是指国家食品药品监督管理局(CFDA)认可的、具有医疗器械检验资质、且检验项目在其承检范围内的医疗器械检测机构,依据产品技术要求对申报产品进行全项目检验,并出具检验报告。目前CFDA认可的有资质的检验机构共有53家,其中国家级检验机构10家。注册检验属事业性质,不收取任何费用,但需排队候检,周期慢且无法确定,依据检测机构目前承接项目预计周期。其报告具有权威性,并能获得药监部门的认可。随着新版《医疗器械注册与备案管理办法》的实施,以前针对第二、三类医疗器械注册检验的概念越来越淡化,委托检验和企业自检逐渐走进行业舞台。
委托检验是企业委托药监认可的检测机构或者第三方检测机构,依据标准和产品技术要求对产品安全性有效性做出技术评价,并取得检验报告的过程。委托检验具备商业性质,收取加速检测的费用,周期相对普通的注册检验较快。委托的检验机构不限于药监系统,第三方有检验检测机构资质认定证书及CMA资质,且承检范围内有对应标准的都可以。
但第三方机构是否有能力真正比肩药监系统下医疗器械专业检测机构所执行的检验检测程序仍是一个重大挑战,目前第三方出具的检测报告可能不被认可。
注册自检是医疗器械注册申请人按照产品技术要求,自行对其申报的产品进行全项目检验,并出具自检报告。注册申请人开展自检工作,包括自己公司检测、委托受托生产企业检测,这些都不需要任何资质,但应具有产品技术要求中相应的自行检验能力,包括具备相应人员、设备、设施和环境等,并按照质量管理体系要求开展检验。自检工作将会纳入医疗器械质量管理体系核查中。
为规范自检程序,2021年10月21日国家药品监督管理局印发了《关于医疗器械注册自检管理规定》(国家药品监督管理局公告第126号)。自检不是放松要求,而是意味着企业将承担更多的主体责任,是落实注册人为第一责任人的一个具体表现。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

医疗器械注册证是依照法定程序,对拟上市销售、使用的医疗器械的安全性、有效性进行评价,决定同意其销售、使用后发放的证件,由国家食品药品监督管理总局统一制定。"
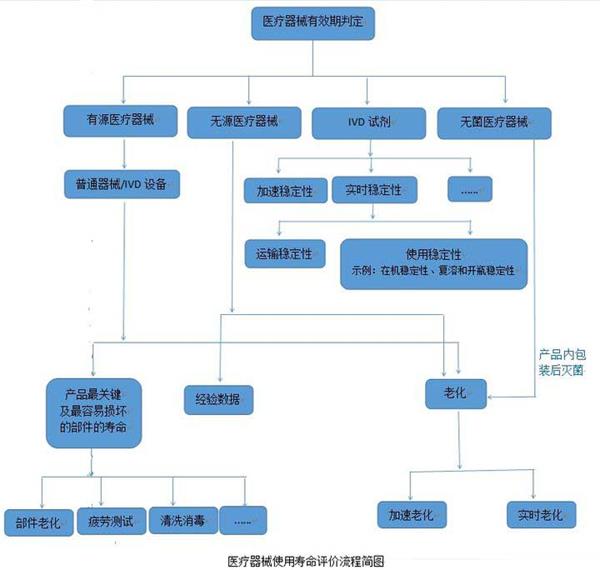
医疗器械的使用寿命是指医疗器械从规划、设计、生产、销售、安装调试到使用、维修、维护检测、报废的全过程。而医院使用的医疗器械的应用质量和安全管理在整个寿命过程中占重

病例报告表(CRF)是临床试验中记录临床资料的表格,每一受试者有关试验的资料均应记录在预先按试验方案设计的病例报告表中。它们依据原始记录而填写,以便申办者对不同试验单

从事医疗器械注册的小伙伴们可能都为同一个问题苦恼过,那就是医疗器械注册单元的划分。企业所设计开发出的产品,其所包含的产品范围,是否可通过一个注册单元完成注册,从而

在临床试验中,无论是监查员、质控人员或者项目管理人员到研究中心查看项目资料的时候,总会多多少少发现一些问题,有些问题可能大家都比较熟知,但处理手法五花八门的。处理

随着医疗器械出口的日益增长,根据市场的需求各医疗器械生产厂商需要符合国家和地区的质量体系法规越来越多,所以经常会碰到出处于不同法规或标准的一些比较容易混淆的概念及

刚接触医疗器械CRO行业的小伙伴,在学习文件法规资料的同时,常看到一些英文类专业名词不知道是什么意思。下面,一起看看常见的医疗器械临床试验专业术语......"

临床试验从筛选到立项、启动、入组和中心关闭是一个完整的闭环,什么时候可以开始关闭中心?关闭中心需要做哪些事情?从哪里着手?今天我们就来谈一谈临床试验关中心阶段的那

脱落是每个临床试验中都会出现并且也最让人头痛的现象。但是是什么原因引起脱落而我们怎么才能减少脱落呢?那么我们来谈一下,项目中常见的脱落问题,希望能为各位项目人员提

病例报告表(case report form,CRF)是按照临床试验方案的要求设计的书面文件,用于记录和报告每一名受试者在试验过程中的数据,这种文件一般采用表格(纸质或电子)的形式。"
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台