山东省医疗器械工艺用水现场检查指南(鲁药监械〔2021〕35号)
为规范医疗器械现场检查,提升检查员现场检查能力,指导检查员对医疗器械生产企业工艺用水控制情况的检查,提高企业工艺用水质量安全保证水平,依据《医疗器械监督管理条例》
来源:医疗器械注册代办 发布日期:2019-08-27 阅读量:次

发布时间:2019-08-27
为贯彻落实《国务院办公厅关于印发治理高值医用耗材改革方案的通知》(国办发〔2019〕37号),规范医疗器械唯一标识系统建设,加强医疗器械全生命周期管理,依据《医疗器械监督管理条例》,国家药监局制定了《医疗器械唯一标识系统规则》,现予发布,自2019年10月1日起施行。
特此公告。
国家药监局
2019年8月23日
附件:
第一条 为规范医疗器械唯一标识系统建设,加强医疗器械全生命周期管理,根据《医疗器械监督管理条例》,制定本规则。
第二条 在中华人民共和国境内销售、使用的医疗器械,其唯一标识系统应当符合本规则。
第三条 本规则所称医疗器械唯一标识系统,由医疗器械唯一标识、唯一标识数据载体和唯一标识数据库组成。
医疗器械唯一标识,是指在医疗器械产品或者包装上附载的,由数字、字母或者符号组成的代码,用于对医疗器械进行唯一性识别。
医疗器械唯一标识数据载体,是指存储或者传输医疗器械唯一标识的数据媒介。
医疗器械唯一标识数据库,是指储存医疗器械唯一标识的产品标识与关联信息的数据库。
第四条 医疗器械唯一标识系统建设应当积极借鉴国际标准,遵循政府引导、企业落实、统筹推进、分步实施的原则。
第五条 国家药品监督管理局负责建立医疗器械唯一标识系统制度,制定医疗器械唯一标识系统建设规划,推动各方积极应用医疗器械唯一标识,促进医疗器械全生命周期管理。
省、自治区、直辖市药品监督管理部门负责指导并监督本行政区域内注册人/备案人开展医疗器械唯一标识系统建设相关工作。
第六条 注册人/备案人负责按照本规则创建和维护医疗器械唯一标识,在产品或者包装上赋予医疗器械唯一标识数据载体,上传相关数据,利用医疗器械唯一标识加强产品全过程管理。
鼓励医疗器械生产经营企业和使用单位积极应用医疗器械唯一标识进行相关管理。
第七条 医疗器械唯一标识包括产品标识和生产标识。产品标识为识别注册人/备案人、医疗器械型号规格和包装的唯一代码;生产标识由医疗器械生产过程相关信息的代码组成,根据监管和实际应用需求,可包含医疗器械序列号、生产批号、生产日期、失效日期等。
产品发生可能影响医疗器械识别、追溯的变更或者监管要求变化时,应当创建新的产品标识。
医疗器械停止销售、使用的,其产品标识不得用于其他医疗器械;重新销售、使用时,可使用原产品标识。
第八条 医疗器械唯一标识应当符合唯一性、稳定性和可扩展性的要求。
唯一性,是指医疗器械唯一标识应当与医疗器械识别要求相一致。
稳定性,是指医疗器械唯一标识应当与产品基本特征相关,产品的基本特征未变化的,产品标识应当保持不变。
可扩展性,是指医疗器械唯一标识应当与监管要求和实际应用不断发展相适应。
第九条 注册人/备案人应当按照医疗器械唯一标识的编制标准创建、维护医疗器械唯一标识。
医疗器械唯一标识编制标准应当符合国家药品监督管理局以及符合本规则要求的发码机构制定的相关标准。
第十条 发码机构应当为中国境内的法人机构,具备完善的管理制度和运行体系,确保按照其标准创建的医疗器械唯一标识的唯一性,并符合国家数据安全有关要求。
发码机构应当向注册人/备案人提供执行其标准的流程并指导实施,应当将其编码标准上传至医疗器械唯一标识数据库并动态维护,每年1月31日前向国家药品监督管理局提交按照其标准创建的唯一标识上一年度的报告。
国家鼓励发码机构采用相关国际标准建立唯一标识运行体系。
第十一条 医疗器械唯一标识数据载体应当满足自动识别和数据采集技术以及人工识读的要求。如空间有限或者使用受限,应当优先采用符合自动识别和数据采集技术的载体形式。
自动识别和数据采集技术包括一维码、二维码或者射频标签等形式,鼓励采用先进的自动识别和数据采集技术。
采用一维码时,可将产品标识和生产标识串联,也可多行并联;采用射频标签时,应当同时具备一维码或者二维码。
第十二条 注册人/备案人应当选择与其创建的医疗器械唯一标识相适应的数据载体标准,对以其名义上市的医疗器械最小销售单元和更高级别的包装或者医疗器械产品上赋予唯一标识数据载体,并确保在医疗器械经营使用期间唯一标识数据载体牢固、清晰、可读。
第十三条 国家药品监督管理局制定医疗器械唯一标识数据相关标准及规范,组织建立医疗器械唯一标识数据库,供公众查询。
第十四条 注册人/备案人应当按照相关标准或者规范要求上传、维护和更新唯一标识数据库中的相关数据,并对数据的真实性、准确性、完整性负责。
第十五条 注册人/备案人应当在申请医疗器械注册、注册变更或者办理备案时,在注册/备案管理系统中提交其产品标识。
注册人/备案人应当在产品上市销售前,将产品标识和相关数据上传至医疗器械唯一标识数据库。
第十六条 药品监督管理部门可根据监管需求调用和管理相关数据。
鼓励各相关方采用先进信息化手段、应用医疗器械唯一标识,对医疗器械在生产、经营、使用等环节进行管理。
第十七条 本规则下列用语的含义:
自动识别和数据采集,是指不通过键盘直接将数据输入计算机系统或者其他微处理器控制的设备的技术。
人工识读,是指与机器识读媒介相对应的,可由人眼直接识别的编码信息。
第十八条 本规则自2019年10月1日起施行。分类实施的具体步骤另行制定并公布。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
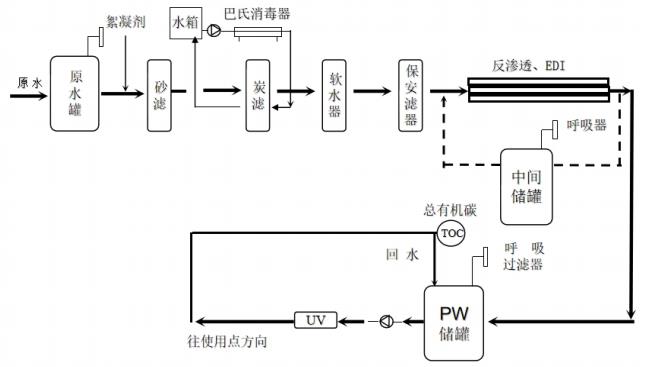
为规范医疗器械现场检查,提升检查员现场检查能力,指导检查员对医疗器械生产企业工艺用水控制情况的检查,提高企业工艺用水质量安全保证水平,依据《医疗器械监督管理条例》

《海南博鳌乐城国际医疗旅游先行区临床急需进口药品带离先行区使用管理暂行办法》已经3月24日海南博鳌乐城国际医疗旅游先行区领导小组会议审议通过,现印发给你们,请遵照执行

为深入贯彻落实中共中央办公厅、国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),按照国家药品监督管理局《关于扩大医疗器械
《海南博鳌乐城国际医疗旅游先行区医疗机构制剂调剂使用管理暂行办法》已经3月24日海南博鳌乐城国际医疗旅游先行区领导小组会议审议通过,现印发给你们,请遵照执行。

为规范医疗器械注册人跨区域委托生产的监督管理,推进长江三角洲区域医疗器械跨区域监管,根据《中共中央办公厅国务院办公厅关于深化审评审批制度改革鼓励药品医疗器械创新的意见》《

国家药监局关于发布免于进行临床评价医疗器械目录的通告(2025年第19号)发布时间:2025-05-13为做好医疗器械注册管理工作,根据《医疗器械注册与备案管理

关于发布医疗器械质量管理体系年度自查报告编写指南的通告(2022年第13号)发布时间:2022-03-24为加强医疗器械生产监管,保障医疗器械安全有效,根据《医

附件:医疗器械监督管理条例(2025年修订版).doc医疗器械监督管理条例(2000年1月4日中华人民共和国国务院令第276号公布 2014年2月12日国务院第

为加强医疗器械生产监督管理,规范医疗器械生产质量管理,根据《医疗器械监督管理条例》(国务院令650号)、《医疗器械生产监督管理办法》(国家食品药品监督管理总局令第7号)

国家市场监督管理总局令 第47号 《医疗器械注册与备案管理办法》已经2021年7月22日市场监管总局第11次局务会议通过,现予公布,自2021年10月1日起施行。 附件: 医疗器械注册与备案管
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台