医用冷敷贴可以每天使用吗?天天用?长期用吗?
医用冷敷贴可以每天使用,但是不建议长期每天使用。医用冷敷贴安全性比较高,而且功效也明显,更适合皮肤出现问题的时候使用,如果皮肤没有什么皮肤问题,使用起来可能和一般
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
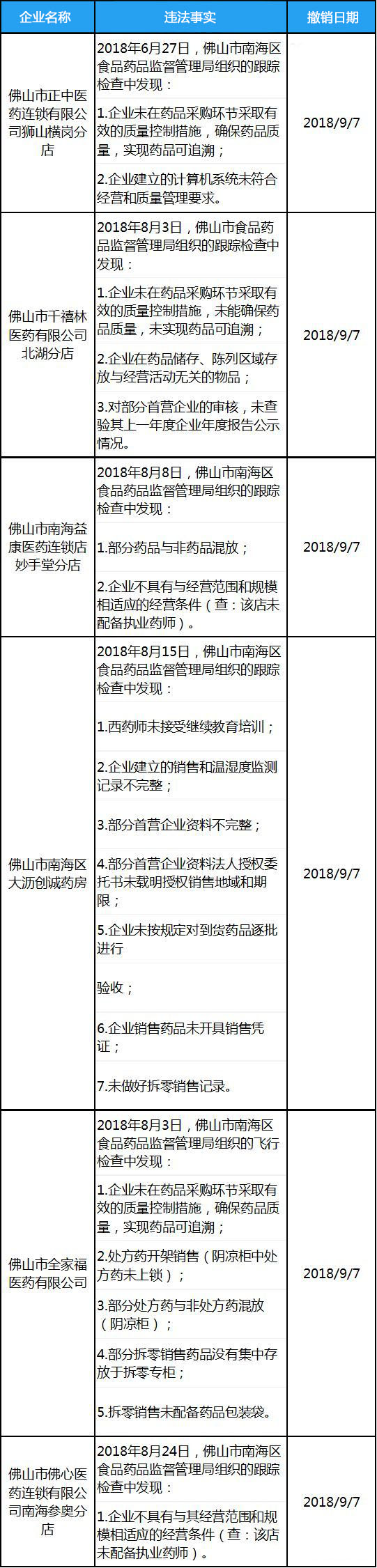
2018年9月17日,佛山市南海区食品药品监督管理局发布飞检公告,现场检查发现佛山市正中医药连锁有限公司狮山横岗分店等6家药品零售企业严重违反GSP规定。
当局依据《药品经营质量管理规范认证管理办法》第四十五条,依法撤销其《药品经营质量管理规范认证证书》,并根据《广东省食品药品监督管理局药品生产经营单位信用分类管理的实施办法》(粤食药监法〔2014〕109号)规定,评定其信用等级为“严重失信” 。
这些药房都存在什么问题?
GSP是《药品经营质量管理规范》的英文缩写,是药品经营企业统一的质量管理准则。药品经营企业应在药品监督管理部门规定的时间内达到GSP要求,并通过认证取得认证证书。
根据国家药品监督管理局的部署,凡通过本次换证的药品经营企业,将在3~5年时间内进行GSP认证,未能取得GSP认证的企业,在下一轮药品经营企业换证时将取消其经营药品的资格。
被撤销《药品经营质量管理规范(gsp)认证证书》的企业,如再次申请认证,需在撤销证书之日起6个月后方可提出。
在重新获得GSP认证前,暂时不得经营药品。 《药品管理法》第七十九条规定,药品的生产企业、经营企业、药物非临床安全性评价研究机构、药物临床试验机构未按照规定实施《药品生产质量管理规范》、《药品经营质量管理规范》、药物非临床研究质量管理规范、药物临床试验质量管理规范的,给予警告,责令限期改正;逾期不改正的,责令停产、停业整顿,并处五千元以上二万元以下的罚款;情节严重的,吊销《药品生产许可证》、《药品经营许可证》和药物临床试验机构的资格。
GSP证书被撤销后,企业必须在限期内重新提出认证申请,逾期不申请或申请后经验收仍不符合规定的,将依法撤销其《药品经营许可证》,取消其药品经营资格。

1. 严重缺陷项目超过1项(含)的;
2. 主要缺陷项目超过检查项目10%(含)的;
3. 主要缺陷项目小于10%,一般缺陷项目超过10%(含)的;
4. 一般缺陷项目超过20%(含)的;
5. 存在其他严重违反法律法规的。
1. 严重缺陷项目超过1项(含)的;
2. 主要缺陷项目超过检查项目10%(含)的;
3. 主要缺陷项目小于10%,一般缺陷项目超过20%(含)的;
4. 一般缺陷项目超过30%(含)的;
5. 存在其他严重违反法律法规的。
收回就是看处理结果,有的是提交整改报告,有的是委托当地药监局在来现场看一次,然后在把证还给你。
撤销就是你这GSP证书废了,看处理结果,如果许可证没被吊销,那么处理完后,规定要半年的整改期限不能经营,半年后在申请GSP认证,颁发新证。
如果在此期间你药品许可证也耽搁过期了,那么你就没资格申请换许可证和申请GSP认证了。
简单来说,被撤销就没有余地了,被收回经过整改还可以重发的。

飞检加强,对药企来说,无疑又敲响了一记警钟。
作为一种公众认可的较为严格的监督管理手段,飞检的检查的力度和细致程度可想而知。除了常规的产品质量、产品仓库检查,飞检检查的内容甚至还包含企业的职责权责文件明细、销售系统管理软件、产品审核出售记录等等。又因为是突击检查,来得突然,罚得迅速,省去了很多形式主义的东西,这也就导致大多数接受检查的药企根本没有时间“装饰门面”,就这样一脸茫然地“中了招”,被通报批评或是责令整改。
面对不断加强的突击飞检,药企需要做的就是保证自己的产品环境及质量,大力提升企业内的监管力度,提高水平;同时注意文件管理、销售记录等小细节,尽量按照国家出台的规定要求做到面面俱到。只有自己做的到位,才会胸有成竹,才会不惧怕任何突击检查。总之,想要在药品零售行业生存下去,保护好GSP证书吧!

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

医用冷敷贴可以每天使用,但是不建议长期每天使用。医用冷敷贴安全性比较高,而且功效也明显,更适合皮肤出现问题的时候使用,如果皮肤没有什么皮肤问题,使用起来可能和一般

临床试验从筛选到立项、启动、入组和中心关闭是一个完整的闭环,什么时候可以开始关闭中心?关闭中心需要做哪些事情?从哪里着手?今天我们就来谈一谈临床试验关中心阶段的那

脱落是每个临床试验中都会出现并且也最让人头痛的现象。但是是什么原因引起脱落而我们怎么才能减少脱落呢?那么我们来谈一下,项目中常见的脱落问题,希望能为各位项目人员提

皮肤出现问题每个人都会很在意,不仅是疼痛不好受,脸上出现红肿或发炎都是会影响到自己的整体美观,谁不想美美的呢。特别是换季时温差比较大,皮肤很容易出现问题,这种情况

病例报告表(case report form,CRF)是按照临床试验方案的要求设计的书面文件,用于记录和报告每一名受试者在试验过程中的数据,这种文件一般采用表格(纸质或电子)的形式。"

在临床试验方案的设计过程中,大家都会尽可能的考虑到各种可能影响试验的因素,并制定标准操作规程,尽量避免和减少在试验中可能出现违背及偏离方案的情况发生,但在试验的执

市面上销售的面膜主要有妆字号面膜和械字号面膜,医用冷敷贴面膜属于械字号面膜。医用冷敷贴面膜的功能在于受损肌肤修正,用于湿疹、过敏等皮肤状态,起到一个辅佐医治的作用

招募广告是临床试验中用以招募受试者的一种方法,随着药物、器械临床试验以及研究者发起的涉及人的生物医学研究越来越广泛地开展,临床试验中招募广告的使用也日益频繁,甚至

近期,全国多地对成人用品合规销售开展抽查,多个无证销售企业被行政处罚。本文说说拼多多上成人用品销售,需要办理的资质有哪些?

大家在项目中,是否遇到过ICF更新的情况?在ICF更新后,已由受试者签署的知情同意书,是否需要重新签署呢?又有哪些情形不需要重新签署呢?本期我们继续跟大家分享知情同意书实
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台