干货|临床SSU工作内容和具体工作流程
SSU是Study Start Up的缩写,从最初的项目准备,到启动访视(Site Initiation Visit)之前所有的准备工作,对整个临床研究项目的启动非常关键。负责这个关键阶段工作的部门人员,就叫做SS
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
我是草莓冰淇淋,最近我的项目终于在上海市东方医院启动并入组了,利用空余时间,梳理一下东方医院的SSU流程,希望能对各位的工作有所帮助~

上海市东方医院目前一共两个院区,本部在即墨路,南院在云台路。由于中心大部分试验在南院开展,机构、伦理目前均在南院区,办公室是同一个,机构和伦理接待日是每周一及周四。建议大家在开展项目前,加入东方医院机构钉钉群——“上海市东方医院GCP工作”,群里文件非常全,对于SSU阶段流程常见问题,机构主任施燕老师已经整理Q&A,方便大家的查阅。
对接老师:机构谭老师;
对接时间:接待日周一、周四(若接待日有变更,将在钉钉群通知);
立项流程:按照机构文件要求准备资料,先在CTMS系统中上传材料,可同步递交纸质版材料至机构处审核,如果材料没有问题,通常一周可完成立项,CTMS系统也会发短信进行通知。
Tips:
1、由于谭老师还要负责一期药房的工作,一般在机构办公室的时间是早8:00 ~ 9:00以及13:00 ~ 14:00,建议机构开门就去排队哦。
2、中心的CTMS系统只能使用内网进行登录,不限于机构的电脑,任何一部东方医院的电脑均可,网址是http://172.31.11.21/
3、电子版材料需要盖章,签字的扫描件。
4、立项的同时,准备好1寸照片进行工牌和饭卡的办理。
对接老师:伦理鲍老师;
对接时间:接待日周一、周四;
伦理流程:立项通过后,即可进行伦理材料的递交。纸质版材料递交前,仍需在CTMS系统上先行上传电子版材料,纸质版材料可以同步进行递交。关于伦理会时间:每个月下旬召开,一般每月15日之前递交伦理材料,可以赶上当月的伦理会。伦理的审核结果也会及时在CTMS系统中更新。确定上会时间后,鲍老师会邮件通知,会要求提前发送PPT,并进行伦理审查费用的支付。通常2周内出批件/意见函,若进行复审,修改的材料也需先进行CTMS提交,再将纸质版材料递交伦理审查。复审通常是走快审的,从递交材料到拿批件通常两周内。
Tips:
1、关于ICF中费用相关的描述,伦理要求需要明确写清申办方承担哪些费用,还建议各位小伙伴在递交前先行检查并与伦理老师确认哦;
2、伦理会当天需CRA或者CRC陪同进行简版材料的分发。
由于东方医院合同签署的流程比较长,建议大家提前谈好合同,伦理审查期间,即可发合同于邮箱austainsy@163.com审核,审核时长一般为1-2周。出伦理批件后,机构即可开始走盖章流程,合同签署时间通常3~4周,偶尔也会出现2周内完成签署的情况。
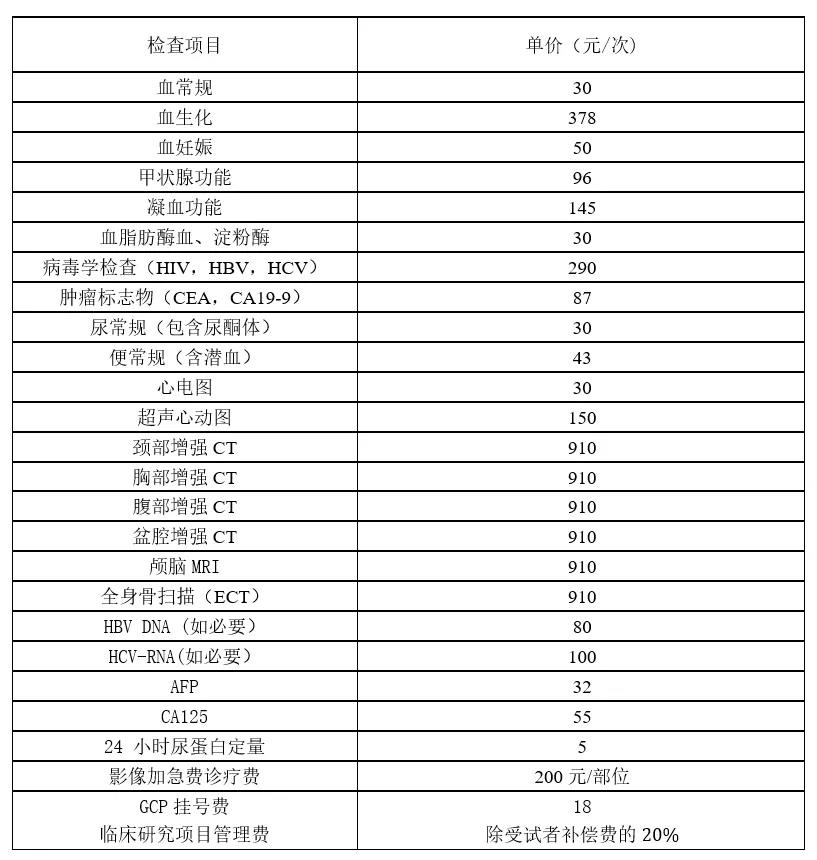
费用清单可看下图。
东方的遗传办流程比较简单,发送相关材料到科研科孙翰东的邮箱dfny2012@163.com,孙老师协助上传医院OA系统后,直接拿纸质版材料到本部院区院办进行盖章即可。
关于SMO:机构目前是没有优选推荐名单的,如果在肿瘤科开展临床试验,一期通常会选用始达,二三期试验始达目前不再承接,申办方自行选择SMO公司。
关于发票:伦理费或者临床试验费用需填写相关表格,伦理或机构老师签字后,送至本部新大楼财务部,两周后可领取发票。
关于质控:机构无启动质控,受试者入组前两例、1/3 受试者入组、关中心时和机构王昕老师预约质控。
关于药房:中心药房管理,一期药房老师为谭老师,二三期药房联系马老师。
作者:草莓冰淇淋

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

SSU是Study Start Up的缩写,从最初的项目准备,到启动访视(Site Initiation Visit)之前所有的准备工作,对整个临床研究项目的启动非常关键。负责这个关键阶段工作的部门人员,就叫做SS

初次申请消字号备案,总会遇到磕磕绊绊的问题,常见的有申请流程、申请资料、申请周期等问题,本文将对申请消字号产品流程及费用简单概述,对即将进入消毒产品行业的企业做一

临床研究协调员(全称Clinical Research Coordinator,简称CRC):指经主要研究者授权,在临床试验中协助研究者进行非医学性的相关事务性工作,是临床试验的参与者。 临床试验现场管理组

大多数CRO公司在临床试验现场启动会(SIV)上,常由CRA主导。作为一名有上进心的CRA必须清楚的了解到临床试验现场启动考察的流程,再分享一些本人在启动会考察的细节,请看下文。

目前,临床研究注册的要求是,前瞻性随机对照研究必须在研究开始前注册,观察性研究目前尚无统一要求,但有需要注册的趋势(脊柱外科前瞻性的研究不注册,文章一般很难发表,

俗话说“知己知彼,百战不殆”,对于作为CRC的我们,自认为对CRA其实已经很了解了,但是在我们工作过程有一个角色平时接触不到,但是却又绕不开躲不过,尤其是面对满屏EDC query的

关中心访视(Close Out Visits,简称COV),想必大家都听说过。作为临床试验最后一个阶段,COV也是非常重要的一个环节,今天和大家分享一下作为监查员在COV时应该做哪些工作。什么时候

任何国家医疗器械产品出口澳大利亚,需经历TGA注册,以下是关于澳大利亚医疗器械注册知识点,简单了解一下,文中大致概括了注册全流程,未标明细节,如有产品需要澳大利亚注册

不少朋友问我,什么是SSU,SSU的CRA能去吗,SSU的PM能去吗?在这里,小君就切身经历对SSU的接触,介绍给大家,如果有说得不对或认识错位,欢迎在评论区撕逼!"

根据《医疗器械监督管理条例》(国务院令第650号),第三类医疗器械注册时需要提交产品的检测报告,并且注册申请资料中的产品检测报告应当由具有承检资格的医疗器械检验机构出具
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台