申请消字号产品流程及费用
初次申请消字号备案,总会遇到磕磕绊绊的问题,常见的有申请流程、申请资料、申请周期等问题,本文将对申请消字号产品流程及费用简单概述,对即将进入消毒产品行业的企业做一
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
最近FDA也发布了新的UDI规则,新的指导文件旨在为申请UDI豁免、替代方法和执行延期提供指导。接下来,跟大家聊一聊FDA关于UDI的最新要求。

FDA 发布了关于非植入的、维持或保障生命(LS/LS)的 I 类和未分类器械合规日期的指导文件,下表为FDA在2022年9月24日之前不打算为此类器械执行的要求。
| 要求 | 法规 |
| UDI标签 | 21 CFR 801.20 & 801.50 |
| 直接标记 | 21 CFR 801.45 |
| GUDID数据提交 | 21 CFR 830.300 |
| 标准数据格式 | 21 CFR 801.18 |
此外,在此指导文件中FDA也说明了直接标记的要求,对于在规定的直接标志符合日期之前制造并贴标且仍保留在仓库中的III类、 LS/LS类和II类非无菌成品器械以及在2022 年9月24日之前制造并贴标且仍保留在仓库中的非无菌的 I 类成品和未分类器械,如果该器械带有非UDI标记且贴标商已开发出使用该非UDI标记的方法,那么FDA不打算针对这些器械强制执行UDI的直接标记要求。受 UDI 直接标记约束的特定器械的政策的具体信息请参考下表,需要注意的是,可植入器械不受直接标记要求的约束。
| 器械类别 | _ | _ |
| I类及未分类器械 | 非灭菌 | 在2022年9月24日之前制造并贴标 |
| 除植入式、维持生命或支持生命(I/LS/LS)器械外的II类器械 | 非灭菌 | 在2018年9月24日之前制造并贴标 |
| 灭菌 | 在2016年9月24日之前制造并贴标 | |
| LS/LS器械 | 非灭菌 | 在2015年9月24日之前制造并贴标 |
| 灭菌 | ||
| III类器械 | 非灭菌 | 在2016年9月24日之前制造并贴标 |
| 灭菌 | 在2014年9月24日之前制造并贴标 | |
| 各种类型的寄销和租借器械 | 非灭菌/灭菌 |
在适用的标签符合日期之前寄销和租借: III类:2014年9月24日 LS类:2015年9月24日 II类:2016年9月24日 I类:2018年9月24日 |
在801.30章节中规定了可豁免UDI标识要求的特定类别医疗器械的一般豁免情况,如满足豁免情况,医疗器械可以豁免UDI的要求,同时,801.30章节里还明确了豁免UDI的器械贴标商不需要向FDA提交UDI标识豁免申请。
如果器械无法豁免UDI的要求,且UDI的要求对某一器械不具备技术可行性,或另一法规要求能比21 CFR 801 Part B部分的要求提供更为准确、精准、快速的器械标识或其他法规要求,能更好地保证器械的安全性或有效性时,贴标商可以向FDA提交豁免或替代器械的标签必须带有唯一器械标识符或其他 UDI 要求的申请。FDA可以批准豁免或替代方法,如果FDA批准UDI豁免或替代方法的申请,FDA可能添加适当的保障措施或条件要求以确保医疗器械在其销售或使用过程中具备充分的标识。在向FDA申请UDI豁免或者替代方法时,申请人需要考虑以下要素:
1)识别可能适用UDI法规豁免或替代方法的器械;
2)识别21 CFR 801 Part B部分中规定为UDI法规豁免或替代方法申请的对象;
3)如果申请豁免,请解释为什么 21 CFR 801 Part B 的要求不具备技术可行性;
4)如果申请替代方法,请说明替代方法的法规并解释为什么该法规能够提供比 21 CFR 801 Part B部分的要求更准确、精准或快速的器械识别,或能更好地保证器械的安全性或有效性;
5)如果有,请提供可能会受到FDA批准决议影响的标签数量和器械数量;以及
6)提供其他必要信息,以说明该豁免或替代方法申请的范围及影响。
根据21 CFR 801.55(c)的规定,如果该规定对某一器械不具备技术可行性时,FDA将考虑批准UDI豁免或替代方法的申请,但FDA估计这种情况将会非常罕见。针对豁免或替代方法申请,FDA将不予考虑一些情况,包括但不限于财政负担、申请人声明的低不良事件率、或声称产品具有免于发生不良事件的特殊性。
虽然FDA提供了UDI豁免和替代方法这一执行路径,但为了建立能在销售及使用过程中充分识别医疗器械的体系,FDA还是期望绝大部分医疗器械能够并且实际上应该在其标签上标示UDI标识,除非801.30中另有规定。FDA建议贴标商可采用以下方式解决标签尺寸不足或独特包装的问题:
若上述方法无法解决贴标商的问题,贴标商可考虑申请21 CFR 801.55 规定的UDI替代方法,如:增加外包装以标示UDI或在产品包装上的其他地方粘贴另一个标签以标示UDI。
最后,要提醒贴标商的是,贴标商应确定豁免或替代方法是否适用于自身情况。如果适用,这种替代方法的适用性和使用应作为标签规范的一部分记录在设备主记录(DMR)中,该替代决定的副本也应包含在 DMR 中。
FDA认为,最终UDI规则中列出的分阶段实施时间表已为III类、I/LS/LS和II类器械的标签提供了充足的时间,使其在2016年9月24日之前符合所有适用的UDI要求。因此规定非植入式、维持生命或保障生命(I/LS/LS)的II类器械的UDI标签和GUDID提交合规日期为2016年9月24日。此外,当确定延期符合公众健康的最大利益时,FDA已授予特定类型器械的贴标商延长其UDI合规日期。
根据21 CFR 801.57(a)的要求,自医疗器械标签上必须有UDI之日起,分配给该器械的任何国家健康相关项目代码(NHRIC)或国家药品代码(NDC)编号将被撤销,且不再出现在器械标签或包装上。如果一个器械不要求在其标签上印有UDI,根据21 CFR 801.57(b)的要求,则分配给该器械的任何NHRIC或NDC代码将于2018年9月24日起撤销,且不再出现在器械标签或包装上。对于在2023年9月24日之前制造并贴标签的成品器械,FDA不反对在器械标签和器械包装上使用传统的FDA标识。此外,FDA不会为了将NDC分配给非药物产品或在UDI发布系统下使用而分配新的标签代码,先前已获得过FDA标签代码以促进器械上NHRIC或NDC号码使用的贴标商,如果与FDA认可的发行机构的指导原则一致,可继续使用该标签代码作为其UDI的一部分。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

初次申请消字号备案,总会遇到磕磕绊绊的问题,常见的有申请流程、申请资料、申请周期等问题,本文将对申请消字号产品流程及费用简单概述,对即将进入消毒产品行业的企业做一
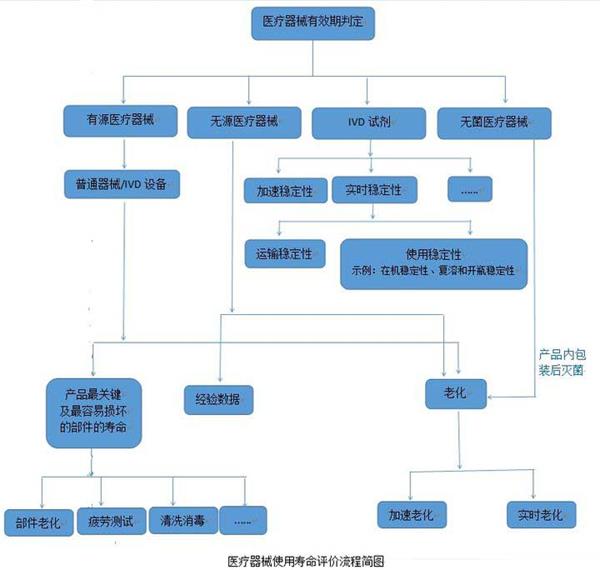
医疗器械的使用寿命是指医疗器械从规划、设计、生产、销售、安装调试到使用、维修、维护检测、报废的全过程。而医院使用的医疗器械的应用质量和安全管理在整个寿命过程中占重

俗话说“知己知彼,百战不殆”,对于作为CRC的我们,自认为对CRA其实已经很了解了,但是在我们工作过程有一个角色平时接触不到,但是却又绕不开躲不过,尤其是面对满屏EDC query的

欧盟自由销售证明是指欧盟国家主管当局出具的自由销售证书,全称为Certificate of Free Sale或Free Sales Certificate,简称CFS或FSC。本文重点讲解企业申请欧盟自由销售证书的条件和自由销售证

NIOSH认证的申请步骤:制造商先建立完整合格的质量管理体系、制造商生产样品送检Nelson获取预检测报告、向NIOSH申请三位数的制造商编码并对制造商资质进行评估、制造商准备申请资料

化妆品备案怎么申请的?首先要搞懂在哪申请?化妆品归国家药监局管理,因此,需要到国家药监局官网申请。而化妆品又分为国产普通化妆品、国产特殊化妆品、进口普通化妆品、进

随着医药、食品工业的发展,新的净化车间不断建设,原有的生产厂房也必须进行改造,使之符合现代洁净生产的要求。制药厂固体制剂时需要一个特殊的环境,这个环境必须符合标准

对制药厂各GMP洁净区压差进行控制,其目的是保证洁净室在正常工作或平衡暂时受到破坏时,空气都能从洁净度高的区域流向洁净度低的区域,使洁净室的洁净度不受到污染空气的干扰
医疗器械唯一标识(UDI)贯通医疗器械生产经营使用各环节,能确保医疗器械生产和使用安全,是医疗器械非常有用的身!份!信!息!作为医疗器械的身份证,有需要的小伙伴怎么可

消字号即消毒产品批准字号,根据《消毒管理办法》(卫生部令第27号,自2002年7月1日起施行)第四十九的规定,消毒产品包括消毒剂、消毒器械(含生物指示物、化学指示物和灭菌物品
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台