药监:2018年查处医疗器械案件1.8万件,取缔无证经营医疗器械产品188户
日前,国家药监局发布《2018年度药品监管统计年报》(以下简称《统计年报》),该报告数据来源于《药品监督管理统计报表制度》,数据报告期为2017年12月1日至2018年11月30日。"
来源:医疗器械注册代办 发布日期:2025-01-15 阅读量:次

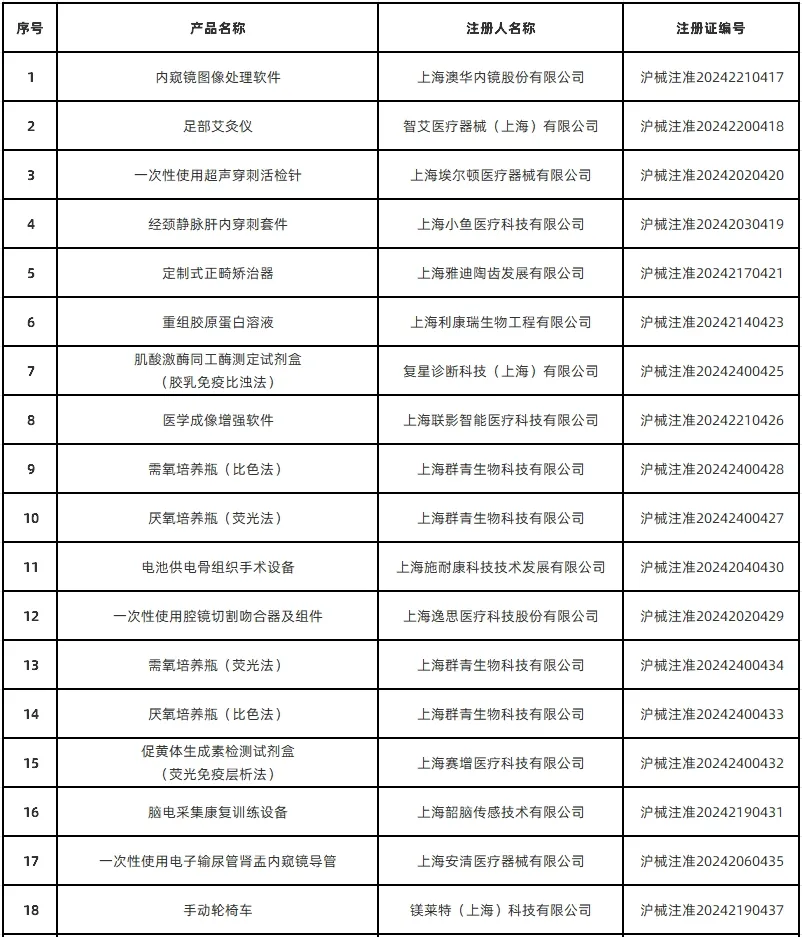
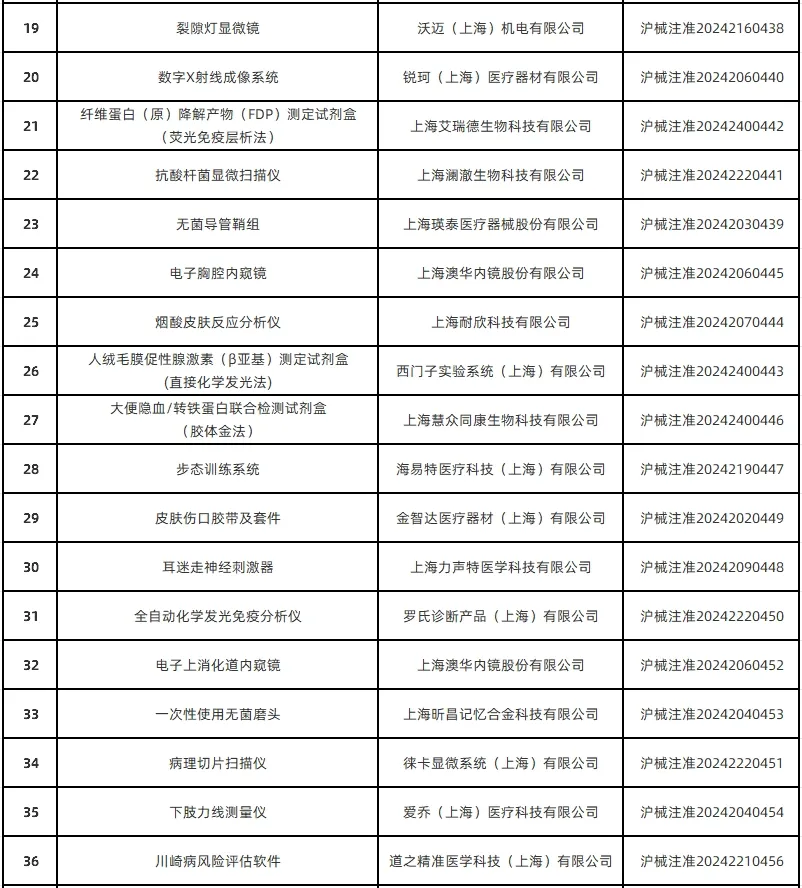
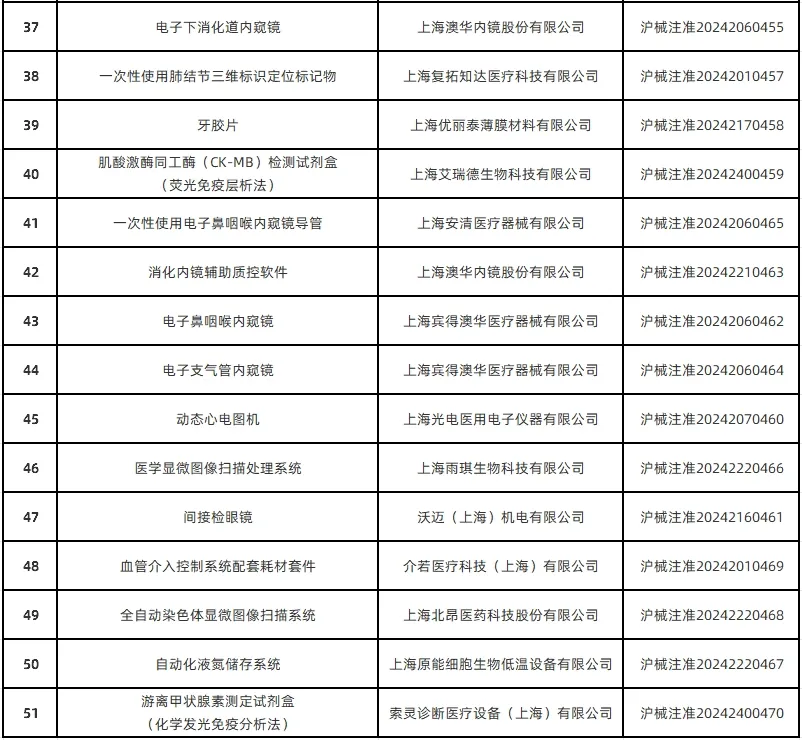
1月13日,上海市药监局通过其官网公布了2024年12月批准的51个首次注册医疗器械产品目录(详见下图)。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

日前,国家药监局发布《2018年度药品监管统计年报》(以下简称《统计年报》),该报告数据来源于《药品监督管理统计报表制度》,数据报告期为2017年12月1日至2018年11月30日。"

自美国总统更替以来,中美双方交替制裁,接触FDA 510K申请的朋友也许留意到,近一两年FDA在评审510K文件时,提出的问题越来越尖锐。联系到近两年的中美关系变化,例如美国打压华为、前两天

国家药监局器审中心关于发布定性检测体外诊断试剂分析性能评估等6项医疗器械产品注册审查指导原则的通告(2022年第36号) 发布时间:2022-09-28 为进一步规范定性检测体外诊断试剂分析

近日,医疗器械唯一标识系统相关两个大事件,一是药监总局发布医疗器械唯一标识系统数据库,一是上海药品监督管理局发布关于印发《上海市推进医疗器械唯一标识系统试点工作方

为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了《关节镜下无源手术器械产品注册审查指导原则》《一次性使用输尿管导引鞘注
为贯彻落实《河南省人民政府推进政府职能转变和“放管服”改革协调小组办公室〈关于做好相关问题整改进一步完提升网上政务服务能力的通知〉(豫“放管服”组办〔2019〕7号)》文件

思途给大家提供正好出差到厦门,给大家分享有关厦门第二类医疗器械产品注册证书申请流程和条件。的全文内容和文档下载,如果您有正好出差到龙岩,给大家分享有关厦门第二类医

2024年全国医疗器械展会一览序号展示名称时间地点网址12024歌华医药健康产业(济南)博览会3.13-3.14山东·济南https://www.ghyjh.com/22024第7届中国(浙江)国际医疗器械展览会3.14-3.16浙江·杭州http://www.cimde.com.cn/32024长三角国际康复设备与训练器材展览会3.14-3.16浙江·杭州www.rete-exbo.com420

昨天写了一篇自己关于赫尔辛基宣言的理解,被网友提醒:尊重从改变称谓开始,新版“参与者”vs旧版“受试者”。所以抓紧学习了新版宣言,并重点研习了这一块,今天就来分

2024版《赫尔辛基宣言》已于前几日正式发布,与老版本相比,有哪些变化呢?下面内容出自作者新猫,一起来看看吧。1. 术语的变化:2024 修订版将“受试者(su
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台