有源医疗器械加速老化试验效期验证及使用期限验证流程
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有
来源:医疗器械注册代办 发布日期:2024-04-12 阅读量:次
2024年初,欧亚经济委员会发布第7号决议—新版《医疗器械临床和临床实验室检验(研究)规则》,本决议更新了欧亚经济委员会2016年2月12日第29号旧临床试验规则。新版规则将于2024年7月27日正式生效。
1.取消对体外诊断医疗器械进行多中心临床试验的要求;
2.澄清伦理委员会可以在医疗组织层面(地方伦理委员会)发挥作用。
下面将对第29号决议和第7号决议中关于何时需要进行临床试验的差异部分做逐一解释:

本次更新中,最关键的法规变化是:如果存在等效医疗器械或相关临床数据,对于风险等级为2b类和3类的医疗器械,人体临床试验将不再是强制;但是如果与等效器械存在差异,仍然需要对差异部分进行人体临床试验。即使是风险等级为1类的医疗器械也是如此。
作者:麦洛克

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
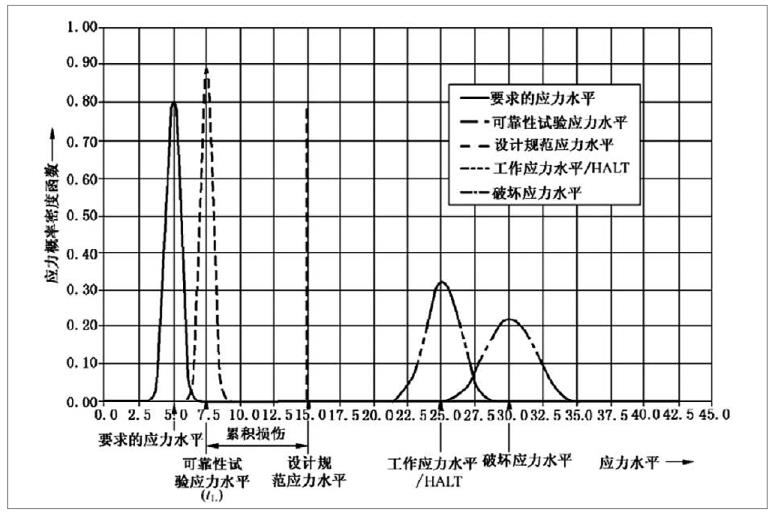
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有

国家市场监管总局于官网公布《药品注册管理办法》(以下简称“办法”)已于2020年7月1日起正式施行。国家药监局从《办法》修订的背景、思路、引入了哪些新理念和制度、有哪些鼓

在我国,体外诊断试剂(IVD)是指:可单独使用或与仪器、器具、设备或系统组合使用, 在疾病的预防、诊断、治疗监测、预后观察、健康状态评价以及遗传性疾病的预测过程中, 用于对人体样

简述了中药新药临床试验主要特点,指出要重视风险、受益评估,重视人 用经验选择科学、客观、合适的有效性指标,做好中医证候疗效评价,鼓励在中药新药临床研究中采用电子化手

本文介绍了欧盟医疗器械新法规MDR相比于将替代的MDD法规的几点新增要求。建议收藏学习。明年5月份起,Medical Devices Regulation(MDR)(2017/745/ EU)将替代原本的Medical Devices Directive (93

从广义讲,远程审核指使用远程信息和通信技术提供完整的认证信息与服务,包括诸如远程受理、远程审核、远程认证审核信息共享等所有认证审核活动;其中管理的重点和难点主要为

医疗器械注册费是行政性收费,按照注册单元收取,部分省份不收取医疗器械注册费用,绝大部分省份还是收取的。本篇文章统计了截止到2022年1月5日各地医疗器械注册收费标准。

为规范医疗器械(含体外诊断试剂)注册管理,根据国家药监局《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2021年第121号)、《关于公布体外诊断试剂注册申报
为服务中国(广东)自由贸易试验区和科创中心国家战略,全面贯彻党的十九大精神和总书记对广东重要指示批示精神,深化供给侧结构性改革,建设健康中国,奋力实现“四个走在全

按照中共中央办公厅和国务院办公厅印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)和《国务院关于修改〈医疗器械监督管理条例〉的决定》(
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台