化妆品备案编号在哪里查询?怎么查化妆品的备案编号?
目前化妆品都要求必须进行备案的,如果不备案就是违法的情况。所以必须进行备案。已经拿到资质的化妆品备案编号在哪里找?怎么找?本文分享常见的化妆品备案编号查询方法。
来源:医疗器械注册代办 发布日期:2023-10-10 阅读量:次
我们学习了什么是PD(方案偏离)和PV(方案违背),那么问题就来了:很多国内小公司和小药企,临床医学团队不是很完善(结构就是:医疗器械临床试验公司配备一个经理+几个CRA),很多问题需要CRA自己解决,问了项目经理等于没问(临床运营的经理也拿不准)。不像有些公司很规范,有主管技术的医学部,有自己医学顾问、医学经理、LM、项目经理、QA、LCRA、丰富经验的SCRA同事等人员,所以即使CRA发现了PD/PV,也是很痛苦,因为SOPs里面并没有说怎么处理,或怎么报,那我们应该怎么做呢,或其他同行是怎么做呢?

临床试验方案的设计过程中,人们总是尽可能的考虑到各种可能影响试验的因素,并制定标准操作规程,建立质量控制和质量保证体系,尽量避免及减少在试验中可能出现违背及偏离方案的情况发生;但在试验的执行过程中,偏离试验方案的情况往往不可避免。不同的国家或申办者对于偏离方案的记录与报告要求不尽相同。然而每个公司SOP和每个方案上面对偏离的处理规定不一样,我们要遵循SOP和方案的规定。
在这里和大家谈一下PD/PV怎么处理,希望能帮到小伙伴们解惑。(在这里就不分PD/PV说了,反正都是PD,下文我们就说轻微PD和重大PD。)
一项临床试验中没有任何的偏离方案的情况是很少见的。既然偏离方案是难以避免的,发生了偏离方案后的记录与报告就至关重要。
PD的报告有3个层次:
①研究者向申办者报告。
②研究者/申办者向伦理委员会报告。
③向政府药品监督管理部门报告。
申办者在临床总结报告中报告;申办者将重大/持续PD发生后中止了研究者/研究机构参与试验的情况上报;研究者上报严重PD(如当地法规有要求)。
第①和第③报告的发起人和报告内容与形式是明确的,但②向伦理委员会报告的描述不十分清楚,因为不同医院的伦理要求不一样,有些医院的伦理不是很完善。可以理解为研究者向申办者报告PD的同时复制一份报告给伦理委员会,也可以是申办者(或通过研究者)定期将收集到的PD呈报伦理委员会。小编认为后一种方式更可取,因为申办者收集PD的途径更全面、确认PD有详细的标准,因而可呈现给伦理委员会本机构发生PD的全貌。
一般来说,如果是轻微PD,监查员要做好记录,和PI沟通和培训,并在监查报告上体现,上报给上级,这是监查员的职责,即①。由申办方汇总,定期向伦理报告,即②。
重大的PD,处理需要向申办方汇报,申办方如判定这是严重PD的话,需要通报PI和通报伦理;视严重程度,选择进行步骤③。
至于病人需不需要剔除,这是很严谨的,需要遵循相关原则和多方共同商议决定。
记录方案违背的表格,应该包含但不限于下面信息:
①PD的类别:如纳入/排除标准类,研究药物类,访视窗类,中止治疗类等。
②严重程度:如需要或不需要在临床总结报告中报告。
③PD日期:PD发生的日期,目的有二:一是有些PD发生后,该PD日期之后的所有数据将被排除在统计分析之外;二是用于监查/质量控制,生成某时间段内发生PD的报告。
④PD描述:用文字描述偏离方的具体情况,这些文字描述最后会出现在临床总结报告的PD一览表中。
⑤检出方法:如监查员现场监查时手工检出,计算机程序自动检出,医学专门人员审查数据清单或研究者PD报告时检出/确认。
⑥在统计分析中的处理方法:如该患者排除在安全分析集外,该患者排除在符合方案集外,该数据访视点之后的观察数据不进入数据分析,进入所有的分析集但需说明相关的偏离方案情况等。各种偏离方案的情况将被如何处理也可以在统计分析计划中说明。
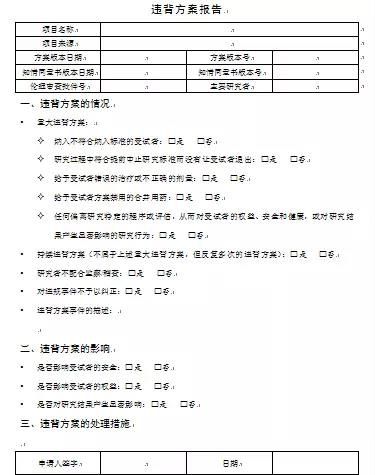
表中除偏离方案情况陈述外,要对偏离行为做出解释,并有针对偏离方案采取的措施,主要研究者签字确认内容,以便于按申办者的要求报告偏离方案信息;有完成表格的指导或培训。
申办方方面,应该有专门的PD数据库,定期生成标准PD汇总表,PD可按试验中心、受试者归类排序,也可按PD的类别或严重程度归类排序。
研究机构收到“违背方案报告”后,应分析问题产生的原因,对因本机构研究人员疏忽大意或对方案理解不足造成的,应监督研究者改进,避免类似情况再次发生;如情况严重或坚持不改,机构可以决定中止研究者参加临床试验;对因机构的研究条件不足造成的,及时完善条件;机构定期对所有的PD进行分类汇总,发现问题趋势,采取相应的措施改进机构的临床试验的系统质量管理。
作者:木木君

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

目前化妆品都要求必须进行备案的,如果不备案就是违法的情况。所以必须进行备案。已经拿到资质的化妆品备案编号在哪里找?怎么找?本文分享常见的化妆品备案编号查询方法。

消字号”产品指的是消毒产品,主要用于杀灭或清除传播媒介上的病原微生物,是卫生部为提高公共卫生质量而批准的一类产品。由省一级卫生主管部门审核批准,是经过卫生部门批准

医疗器械注册证是依照法定程序,对拟上市销售、使用的医疗器械的安全性、有效性进行评价,决定同意其销售、使用后发放的证件,由国家食品药品监督管理总局统一制定。"

PD和PV,对于工作久的CRA来说,是个比较困惑的问题,因为对于方案违背和方案偏离的定义,每个公司SOP或不同项目的要求不一样。有些公司只有PD,有些公司PD和PV分得很清楚,经历了几

方案偏离和方案违背是我们在平时工作过程中,非常容易遇到的一种情况,今天,我们就来聊一下应该 如何做才能更好的降低方案偏离/违背发生呢? 1.定义 其实GCP中并未对方案偏离

在临床试验方案的设计过程中,大家都会尽可能的考虑到各种可能影响试验的因素,并制定标准操作规程,尽量避免和减少在试验中可能出现违背及偏离方案的情况发生,但在试验的执

本文提供临床试验前中后期相关表格模板,文末附免费下载PDF和word版本,有需求自行下载!

我国《药品注册管理办法》规定临床试验分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期,其中Ⅰ、Ⅱ、Ⅲ临床试验在药品上市前进行,而Ⅳ期临床试验是新药临床试验的一个重要组成部分,是对新药上市前Ⅰ

化妆品备案怎么申请的?首先要搞懂在哪申请?化妆品归国家药监局管理,因此,需要到国家药监局官网申请。而化妆品又分为国产普通化妆品、国产特殊化妆品、进口普通化妆品、进

“消字号”产品是经卫生部门审核批准,具有卫生批号的外用卫生消毒用品,包含消毒剂、卫生用品等,例如湿纸巾、女性生理期卫生用品、卫生口罩、卫生手套等。“消字号”产品往
十年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台