有源医疗器械加速老化试验效期验证及使用期限验证流程
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有
来源:医疗器械注册代办 发布日期:2024-09-05 阅读量:次
背景:《中华人民共和国医疗器械管理法(草案征求意见稿)》的公布。——医疗器械的监管即将从现行“监督管理条例”升格为“管理法”。
提到注册证可“买卖”

【原来】买公司,但是一般没有成立公司就为了卖,一般都好多个证在一个公司,做不下去了才想卖,这时候收购方必须买公司,成本高。
【现在】证单独卖降低了收购产品的成本。摆脱了标的公司的人员和整合成本,我猜人力成本可能50%不用花钱收购了。这部分成本应该是标的的员工承担了。
【原来】批很多证,获证不论市面上有多少同类产品,不找关系情况下都需要个半年一年。
【现在】常规注册证,市面上流通的很多,价值不高,直接买不用注册,监管机构减少审批。常规证重复审批减少,总获批注册证数量少了,检查的企业也少了。
【原来】做特殊项目容易前期绑定,竞争加剧后利润下降不易掉头
【现在】代理商转生产,买证变厂家更容易了,转生产之后可以借助之前合作厂家投入的资源左手换右手,尤其是需要投入临床教育的特殊项目。待厂家教育完市场,渠道利润下降时,买证转为自有产品,既享受了之前客户教育红利,又摆脱厂家获取更多利润。
【原来】IVD为例,外包注册的持证公司,必须自有开发和注册记录。假设合规情况下,CRO收钱,证在交钱的一方。需要按步骤来,1、CRO找到客户,2、帮助开发注册,3客户获证,CRO收尾款。
【现在】畅想一下CRO规划十个公司,自己新注册一批证,非集采项目基础款注册证套餐,集采项目烂大街套餐,特殊项目及配套套餐,不同细分领域如分子、介入、高耗、创新器械等,挂网上卖证(或授权销售)。买123公司可组成IVD发光公司,买369可补全平台特色项目,买8910可组成骨科领域检测、治疗、随访、康复一体化公司。
【原来】需求洞察-产品开发-专利布局-注册审批-卖公司退出
科研成果-专利布局-厂家接盘-产品开发-注册审批-卖公司退出(or销售分成回本)
【现在】需求洞察-产品开发-专利布局-注册审批-卖证退出
需求洞察-产品开发-专利布局-卖给注册平台退出(类似孵化器,反正孵化器死的多,捡一个用用)
科研成果-专利布局-卖给注册平台(退出)-产品开发&厂家接盘
国际注册情况虽然不了解,但以NMPA差FDA20年来估计,至少上个世纪别的国家就能买卖注册证。如有不对欢迎各位提醒。
1、IVD没有独占经营时间,获得审批不给独占时间,专利也保护不全面
2、价值不高,药品还能授权国际销售给MNC收一波钱,IVD价值小,空间小,可能只够压一批货给其国家总代
3、目前来看检验替代不了临床,在创新产品选择上,临床倾向于选择创新的治疗产品,而不是创新的诊断产品。
一定是鼓励创新公司
1、小而美创新公司,卖的方式多了
2、已获得大量注册证公司,但销售无起色公司,虽然最终能不能活下去不知道。但卖证能活的更久,或结算时少亏点
3、创新平台公司,有敢投入创新器械产品的公司,手握创新成果+专利+注册证,后面谁去卖都行
有幸与奥X达张总交流,很欣赏奥X达在创新上的坚持投入。敢为人先,做行业内老板们喊得最响做的最少的事。有人担心,没人买单的创新的风险谁来担。不创新都等着行业黄摊子,之后自己去看病时候报告单上每次箭头都不一样,本来需要一个月,看一年都看不好病。手术时候用个耗材,就出血,一直出,还要再做一次手术。关键别的国家不这样。不创新成本就你自己担!
我从一位领导处学到,时空组学是没办法收费,但科学是make sence,它可能是生物学科必不可少的环节,为未来能收费的项目做铺垫。钱花在科学创新上,总比贪官走资之后被“出栏”,在大a交学费强吧?
4、利好产品经理,小而美创新公司需要敏锐观察到创新点,具体到职责就是需要产品经理,小公司老板就是产品经理,那么产品经理里面可能出现更能多小公司老板。大公司产品经理偏重管理,创新主要靠收购,注册证买卖使收购效率更高,大公司需要更多产品经理管理收购的产品。
如果有产品经理组成的顾问组织,也可以通过创新平台公司,转让idea赚钱。
但不得不提的是,如今国内经济形势,除了撒钱,其他政策都需要传导时间。先活下去才能见证未来政策是否带来红利。
跨行业大佬老刘总结,买卖注册证只是手段,通过买卖注册证不能创造额外价值,任何创新都应该务实,否则都是创心!
来源:体外诊断市场部

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
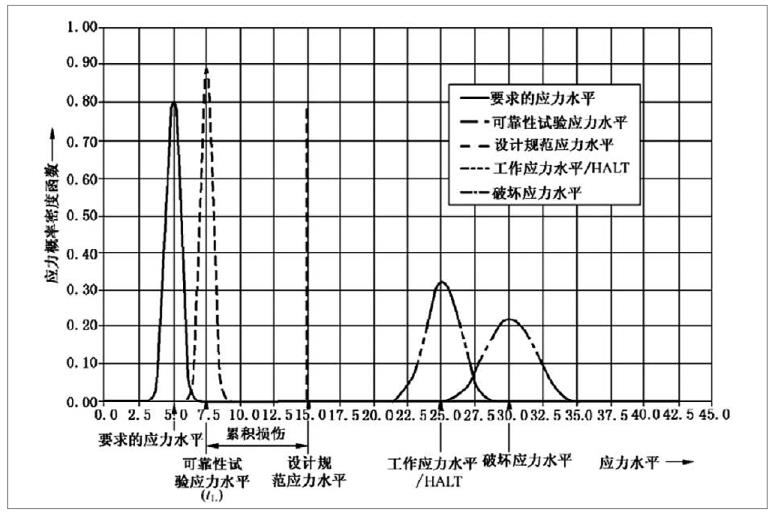
为了确保医疗器械在生命周期内的安全及有效性,注册人应在设计开发中对其使用期限予以验证。使用期限的验证是医疗器械可靠性研究的重要组成部分,制定并验证合理的使用期限有

润滑剂类产品在美国根据产品预期用途的不同主要分为人体润滑剂和患者润滑剂:其中,人体润滑剂主要成分为水、丙二醇、羟乙基纤维素、苯甲酸、卡波姆、氢氧化钠等,作用于生殖

中国能排进世界十大医疗器械制造强国吗?暂时还不能,因为排进前十的国家都有许多知名械企和世界级医疗器械巨头;而中国比较出名的可能只有迈瑞了,其他械企仍需努力了。下面

本文介绍了欧盟医疗器械新法规MDR相比于将替代的MDD法规的几点新增要求。建议收藏学习。明年5月份起,Medical Devices Regulation(MDR)(2017/745/ EU)将替代原本的Medical Devices Directive (93

医疗器械注册费是行政性收费,按照注册单元收取,部分省份不收取医疗器械注册费用,绝大部分省份还是收取的。本篇文章统计了截止到2022年1月5日各地医疗器械注册收费标准。

生物材料在疾病治疗和医疗保健中发挥了重要的作用,按材料性质,生物材料可分为惰性材料与可降解性材料两种,目前生物材料的发展呈现出由惰性向可降解性(水解和酶降解)转变的趋
可吸收高分子材料介绍,及其在植入医疗器械中的应用。1、植入产品的定义国家食品药品监督管理局《医疗器械分类规则》(局令第15号)第八条中对“植入器械”的定义为:任何借助

一个产品带有CE 标志(标记) 也就意味着其制造商宣告:该产品符合欧洲的健康、安全、与环境保护之相关法律中所规定 的基本要求。因而该产品是对:使用者(译者注:人)、宠物(

2021年2月5日,湖南省药监局分别与湖南省计量检测研究院、湖南新领航检测技术有限公司、湖南普瑞玛药物研究中心有限公司、深圳华通威国际检验有限公司、南德认证检测(中国)有限公
为服务中国(广东)自由贸易试验区和科创中心国家战略,全面贯彻党的十九大精神和总书记对广东重要指示批示精神,深化供给侧结构性改革,建设健康中国,奋力实现“四个走在全
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台