《广东省医疗器械注册人制度试点工作实施方案》政策解读
为服务中国(广东)自由贸易试验区和科创中心国家战略,全面贯彻党的十九大精神和总书记对广东重要指示批示精神,深化供给侧结构性改革,建设健康中国,奋力实现“四个走在全
来源:医疗器械注册代办 发布日期:2024-04-07 阅读量:次
广东省药品监督管理局关于10家医疗器械生产企业暂停生产的通告

广东省药品监督管理局
通 告
2024年 第31号
近期,广东省药品监督管理局组织开展医疗器械生产企业监督检查,发现以下10家企业质量管理体系存在严重缺陷,不符合《医疗器械生产质量管理规范》相关规定,广东省药品监督管理局已依法采取责令暂停生产的控制措施。
| 序号 | 企业名称 | 生产许可证编号 |
| 1 | 广州杞梓生物科技发展有限公司 | 粤药监械生产许20235212号 |
| 2 | 创健医疗(深圳)有限公司 | 注册人委托生产 |
| 3 | 深圳市源泰医疗器械有限公司 | 粤食药监械生产许20091816号 |
| 4 | 深圳鸿益生物科技有限公司 | 粤食药监械生产许20193334号 |
| 5 | 深圳市科曼医疗设备有限公司 | 粤食药监械生产许20010456号 |
| 6 | 珠海保税区大生生物科技有限公司 | 粤食药监械生产许20030713号 |
| 7 | 广东百合医疗科技股份有限公司 | 粤食药监械生产许20000009号 |
| 8 | 佛山市驰康医疗器材有限公司 | 粤食药监械生产许20193505号 |
| 9 | 广东精美医疗科技有限公司 | 粤食药监械生产许20101883号 |
| 10 | 佛山市怡创生化科技有限公司 | 粤食药监械生产许20081647号 |
特此通告。
广东省药品监督管理局
2024年4月3日
【文章来源】广东省药品监督管理

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
为服务中国(广东)自由贸易试验区和科创中心国家战略,全面贯彻党的十九大精神和总书记对广东重要指示批示精神,深化供给侧结构性改革,建设健康中国,奋力实现“四个走在全
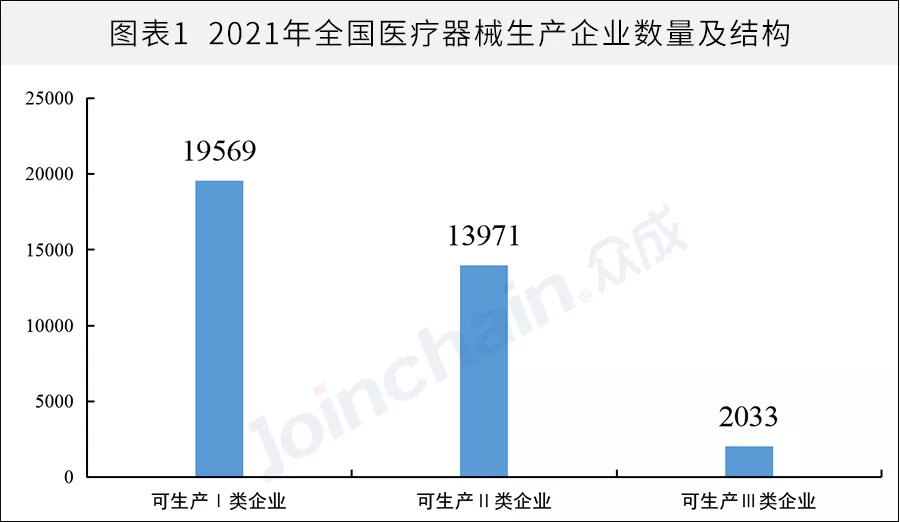
据众成数科统计,截至2021年12月31日,全国医疗器械生产企业数量达28954家,较2020年的25440家同比增长13.8%。其中,可生产Ⅰ类产品企业19569家,可生产Ⅱ类产品13971家,可生产Ⅲ类产品

药品/化妆品/医疗器械企业卖假货无证销售罚多少钱?近期福建省发布药品医疗器械化妆品卖假货无证销售典型案例,一起来看看惩罚力度和罚款额度。"

自美国总统更替以来,中美双方交替制裁,接触FDA 510K申请的朋友也许留意到,近一两年FDA在评审510K文件时,提出的问题越来越尖锐。联系到近两年的中美关系变化,例如美国打压华为、前两天

为进一步规范体外诊断试剂的管理,国家药监局器审中心组织制定了《人类SDC2基因甲基化检测试剂临床试验资料技术审评要点》、《异常凝血酶原测定试剂临床试验资料技术审评要点》

对于企业而言,增长是永远的命题。无论过去赚了多少亿,每一年的开始,又会是一个新问题。
思途给大家提供免于医疗器械注册质量管理体系核查相关说明的全文内容和文档下载,如果您有免于医疗器械注册质量管理体系核查相关说明的相关临床需求请及时找思途,关注思途了

2020年11月9日,广东省药品监督管理局发布《关于调整广东省医疗器械注册审评补充资料预审服务的通告》,详见正文。"
糖尿病是重要的医疗领域之一,目前我国糖尿病医疗费用的市场规模约6000亿元,占中国政府医疗预算的8%。因此政府在制定"健康中国2030"战略时,特将糖尿病等慢性病作为全民医疗的核
广东作为医疗器械产业聚集大省,每一步的动作都关系到行业整体架构,此次文件要求推动高端医疗器械研发产业化,发展高质量植介入产品、康复产品和高性能体外诊断产品。 对于备
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台