GMP、GLP和GCP是什么?有什么区别?
GMP、GLP和GCP是什么?GMP(GOOD MANUFACTURING PRACTICE)良好生产规范:世界卫生组织将GMP定义为指导食物、药品、医疗产品生产和质量管理的法规。GMP要求制药、食品等生产企业应具备良好的
来源:医疗器械注册代办 发布日期:2024-02-20 阅读量:次
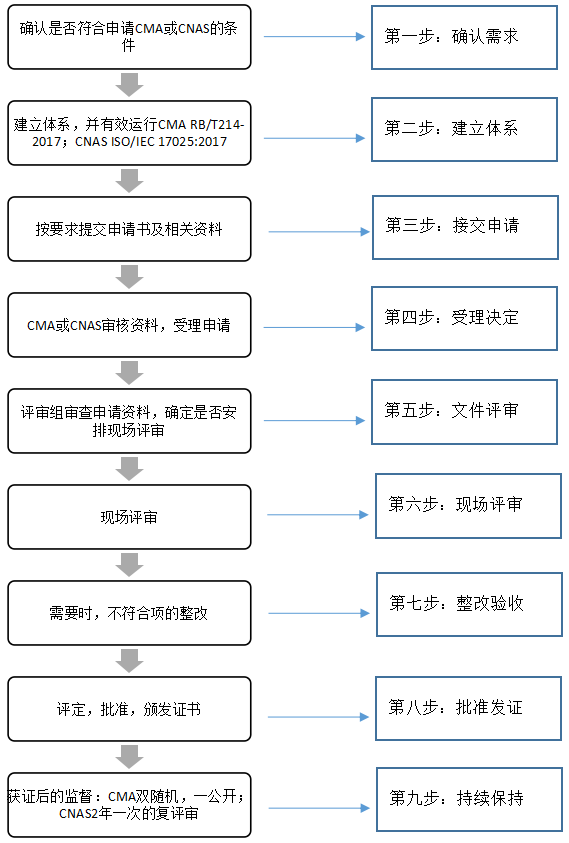
目前,国内主要的实验室资质有CNAS及CMA两种资质认定,CMA计量认证和CNAS实验室认可作为检测报告常用的认证,两者之间既有相同之处,也存在着一些区别。作为国内主要可获得的实验室资质,CNAS和CMA究竟有什么区别?您的实验室到底要拿到哪种资质比较合适?

CNAS是中国合格评定国家认可委员会的英文缩写,是根据《中华人民共和国认证认可条例》的规定,由国家认证与认可监督管理委员会(CNCA)批准设立并授权的国家认可机构,统一负责对认证机构、实验室和检验机构等相关机构的认可工作。
CMA即实验室资质认定,又称计量认证,是依据《中华人民共和国计量法》、《中华人民共和国认证认可条例》等有关法律、法规的规定,对为社会出具公证数据的检验机构进行强制考核的一种手段,是政府对第三方实验室的行政许可,是政府权威部门对检测机构进行规定类型检测所给予的正式承认。实验室获得资质认定证书,才具备向用户、社会及政府提供公正数据的条件和资格。
我国实验室资质认定,由国家认证认可监督管理委员会(CNCA)统一管理,分国家和省两级实施。国家认证认可监督管理委员会统一管理、监督和综合协调实验室的资质认定工作,国家级实验室的资质认定由国家认监委负责实施;各省、自治区、直辖市人民政府质量技术监督部门和各直属出入境检验检疫机构按照各自职责负责所辖区域内的实验室的资质认定和监督检查工作,地方级实验室的资质认定,由地方质检部门负责实施。
CNAS实验室认可证书的评审组织机构和发证机构是中国合格评定国家认可委员会;
CMA分省级和国家级,国家级实验室的资质认定由国家认监委负责,非国家级的实验室一般由所在地省级的质量技术监督局负责组织评审和发证。
CNAS秉承的是自愿、非歧视的原则;
CMA是针对为社会出具公证数据的检验机构进行的强制考核。
CNAS认可对实验室的法律地位没有限制,可以是企业内部的实验室,也可以是独立的第三方实验室;
CMA实验室资质认定的对象,需要是独立的第三方实验室、政府相关部门下属的事业单位实验室等。
通过CNAS认可的实验室在其认可范围内出具的带CNAS标识的报告,可在全球的多个国家和地区通行(双方签署了互认协议MRA);
通过CMA资质认定的实验室在其认定范围内出具的报告只在国内有效。
1.CMA和CNAS通用要求:公正性和保密性。
2.CMA和CNAS结构要求:能承担法律责任,具有管理层和相应人员,在固定的的设施内实施计划申请的检测工作。
3.CMA和CNAS资源要求:包括人员、设施环境、设备(包括标准品/试剂/消耗品)、计量溯源性、外部提供的产品和服务等5方面要求。
4.CMA和CNAS过程要求:包括要求、标书和合同评审、方法选择验证确认、样品、记录、测量不确定度、结果有效性、报告、投诉、不符合工作及数据管理等10方面要求。
5.CMA和CNAS管理体系要求:包括体系文件、文件控制、记录控制、应对风险和机遇的措施、改进、纠正措施、内审和管理评审等8方面要求。
体系文件分为四级,第一级是质量手册,第二级是程序文件,第三级是作业指导书,第四级是记录表格。
(1)CMA体系文件要求:质量手册和程序文件的编写依据是RB/T214-2017《检验检测机构资质认定能力评价检验检测机构通用要求》。
(2)CNAS体系文件要求:质量手册和程序文件的编写依据是CNAS-CL01:2018检测和校准实验室能力的通用要求。
作业指导书编制方法类、仪器设备操作类、期间核查类等作业指导书。记录表格包括技术记录表格、质量记录表格等。
在编写体系文件时要注意几个方面。
第一,防止文件雷同。CMA/CNAS要求如果文件内容雷同,则不予认可。
第二,文件要符合领域要求。即文件的内容必须属于本检测领域。
第三,文件之间有要有衔接。
第四,不可随便添加手册编写依据。
6.CMA和CNAS体系运行要求:体系初次认可必须运行半年以上。包括人、机、料、法、环、测的准备,体系文件的编制和发布,待体系文件发布后再开始体系运行,在运行过程中逻辑清晰、运行有效等。体系运行原则是全员参与、各负其责、相互协作、共同改进。设定岗位包括中心主任、技术负责人、质量负责人、业务室负责人,检验员、内审员、监督员、授权签字人等,在体系运行的过程中要全员参与其中、各负其责,相互协作,以推动质量管理体系更好的运行。
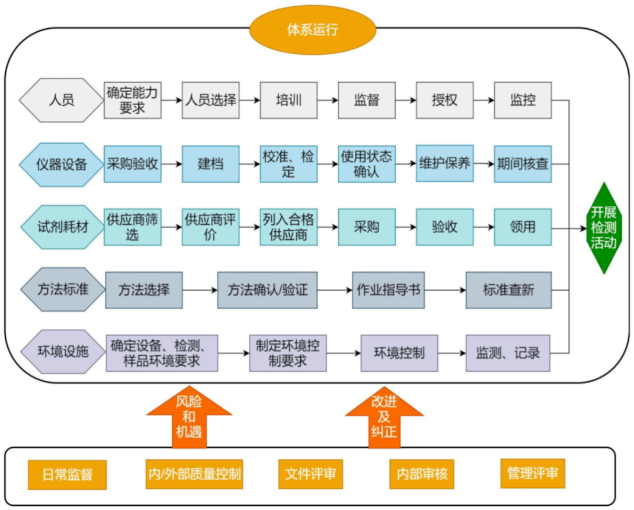
体系运行的流程
评审组依据CNAS-CL01:2018《检测和校准实验室能力认可准则》要求,对实验室环境进行查看,对检测人员、授权签字人及各关键岗位人员以提问、笔试、现场试验和召开座谈会等形式进行考核,并对技术文件、原始记录和质量管理体系的运行情况进行全面细致的检查。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

GMP、GLP和GCP是什么?GMP(GOOD MANUFACTURING PRACTICE)良好生产规范:世界卫生组织将GMP定义为指导食物、药品、医疗产品生产和质量管理的法规。GMP要求制药、食品等生产企业应具备良好的

在购买面膜的时候,通常会看看产品外包装,标注的械字号还是妆字号。械字号面膜通常注册申报为医用冷敷贴,具备特殊的治疗功能。而妆字号面膜是不允许有治疗功能的。除了这个

化妆品外包装上的国妆备进字和国妆网备进字有什么区别?国妆备进字和国妆网备进字,都是进口非特殊用途化妆品备案管理,只是由之前的国家药品监督管理部门受理备案(格式:国

不良事件(Adverse Event,AE)是指在临床试验中受试者发生的任何可能与试验治疗及试验用药品/医疗器械有关或不一定有关的医疗事件。严重不良事件(Serious Adverse Event,SAE)指在任何药物

近期,部分新涉足医疗器械行业的朋友咨询到医疗器械经营许可证与医疗器械经营备案凭证的区别,在此,从以下几个方面来说明医疗器械经营备案凭证和医疗器械经营许可证的异同,

化妆品包装上常看到国妆特字、国妆特进字、卫妆特字、卫妆特进字、卫妆进字、 卫妆备进字、国妆备进字的字样,是不是都被绕晕了,不知道是什么意思?可以查看化妆品批准文号和

CMA是China Inspection Body and Laboratory Mandatory Approval的英文缩写,称作实验室资质认定。是依据《中华人民共和国计量法》、《中华人民共和国认证认可条例》等有关法律、法规的规定,对为

为落实好总局《关于整治医疗器械流通领域违法经营行为的公告》,浙江省药监局要求各市局统一培训检查人员,统筹组织力量,采取异地交叉检查方式,有针对性、有重点地实施监督

“撤回知情同意”、“撤回知情”、“撤回同意”哪一种说法更严谨一些?“withdraw consent”直译为“撤回同意”,知情是已发生的既定事实,无法被撤回;能

在医疗领域,特定设备或系统的运作方式往往是医学工程师和科研人员共同关注的焦点。然而,在深入研究过程中,我们发现“工作原理”和“作用机理”这两个术语之间存在着微妙而重要的区别。拿药物球囊扩张导管产品为例,我们可以深入探讨这两个概念在该产品中的体现。工作原理工作原理主要着眼于设备或系统的运作方式,即在实际操作中,它是如何完成任务的。对于药物球囊扩张导管产品而言,其工作原理可以简单概括为通过球囊的扩张力
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台