临床试验中的单盲、双盲、三盲、破盲是什么意思?
盲法试验常用的有两种:单盲(single blinding)和双盲(double blinding),更严格的对照试验要用到三盲(triple blinding),在对照药物和试验药物剂型或外观不同时,还要用到双盲双模拟技
来源:医疗器械注册代办 发布日期:2025-04-02 阅读量:次
医疗器械临床试验是产品上市前的关键环节,直接关系到产品的安全性和有效性。很多企业在开展临床试验时,常常因为对流程不熟悉或者数据管理不到位而走弯路。今天咱们就来聊聊医疗器械临床试验中那些必须掌握的设计要点和数据管理方法,帮助大家少踩坑。

临床试验设计是整个项目的灵魂所在。设计阶段需要考虑的因素特别多,比如受试者的选择标准、试验的分组方式、评价指标的确定等等。现在比较常见的是采用随机对照试验设计,这样可以最大程度减少偏倚。在设计方案时一定要参考《医疗器械临床试验质量管理规范》的要求,特别是对于高风险的三类医疗器械,方案设计更要严谨。有些企业为了赶进度,往往会忽视样本量的计算,这很容易导致试验结果不被认可。建议在设计阶段就找专业的CRO机构咨询,像思途CRO这样的专业团队能提供从方案设计到注册申报的全流程服务。
数据管理是确保临床试验质量的重中之重。从病例报告表的设计到数据采集的每个环节都不能马虎。现在越来越多的试验采用电子数据采集系统,这样既能提高效率又能减少人为错误。数据管理要特别注意真实性和完整性,所有数据都要做到可溯源。监查员要定期对数据进行核查,发现问题及时纠正。对于关键数据,最好采用双人录入的方式降低错误率。数据管理还要符合《医疗器械临床试验数据递交要求》等法规文件的规定,这些细节往往决定着注册申请的成败。
说到具体操作,不同类型医疗器械的试验要求差异很大。比如骨科植入物注册需要重点关注长期随访数据,而体外诊断试剂则更看重分析性能评价。企业在开展试验前一定要吃透相应的技术审查指导原则。现在审评部门对临床试验数据的质量要求越来越高,有些申报项目就是因为数据管理不规范而被要求补正。建议企业在试验过程中建立完善的质量控制体系,从源头上保证数据的可靠性。
在整个临床试验过程中,选择靠谱的合作伙伴特别重要。专业的CRO公司不仅能提供符合法规要求的设计方案,还能协助处理各种突发情况。就拿多中心试验来说,协调各机构的进度就是个技术活。好的CRO团队会制定详细的项目管理计划,确保试验按时高质量完成。当然,企业自身也要组建专业的团队来监督CRO的工作,毕竟最终责任还是在申报主体身上。
最后提醒大家,医疗器械临床试验是个系统工程,需要设计、执行、管理等各环节紧密配合。从方案设计到数据统计分析,每个步骤都要严格把关。现在注册审评越来越注重数据的真实性和完整性,企业一定要重视临床试验的质量管理。与其后期补数据耽误时间,不如前期就把工作做扎实。相信只要掌握这些核心要点,医疗器械的临床试验和注册申报就能事半功倍。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。

盲法试验常用的有两种:单盲(single blinding)和双盲(double blinding),更严格的对照试验要用到三盲(triple blinding),在对照药物和试验药物剂型或外观不同时,还要用到双盲双模拟技

刚接触CRO行业的小伙伴,在学习文件法规资料的同时,常看到一些英文类专业名词不知道是什么意思。下面,一起看看常见的临床试验专业术语: CRO行业的常用术语解释: 1:新药研发

医学的进步是以研究为基础的,这些研究在一定程度上赖于以人作为受试者的试验。--《赫尔辛基宣言》。Ⅰ期临床研究目的是确定可用于临床新药的安全有效剂量与合理给药方案。根据

SSU是Study Start Up的缩写,从最初的项目准备,到启动访视(Site Initiation Visit)之前所有的准备工作,对整个临床研究项目的启动非常关键。负责这个关键阶段工作的部门人员,就叫做SS

不知道你是否有这样的经历,去医院看病,医生开药写的都是服药中文说明。但药物临床试验相反,有些研究者喜欢写医嘱缩写,比如pc,我第一次看到就不知道什么意思,作为一个好奇

医疗器械注册证是依照法定程序,对拟上市销售、使用的医疗器械的安全性、有效性进行评价,决定同意其销售、使用后发放的证件,由国家食品药品监督管理总局统一制定。"
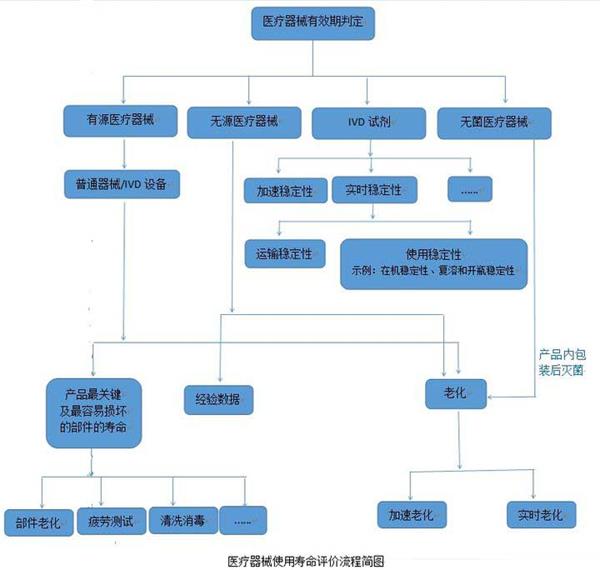
医疗器械的使用寿命是指医疗器械从规划、设计、生产、销售、安装调试到使用、维修、维护检测、报废的全过程。而医院使用的医疗器械的应用质量和安全管理在整个寿命过程中占重
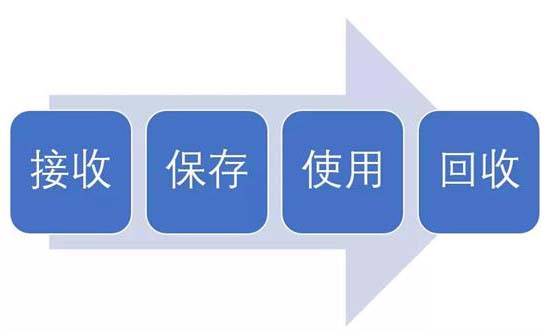
试验用药品是指用于临床试验的试验药物、对照药品。试验用药品渗透到了临床试验过程中的每一个步骤,包括药物的生产、包装、运输、保存、使用、回收等。今天我们从临床试验中

病例报告表(CRF)是临床试验中记录临床资料的表格,每一受试者有关试验的资料均应记录在预先按试验方案设计的病例报告表中。它们依据原始记录而填写,以便申办者对不同试验单

从事医疗器械注册的小伙伴们可能都为同一个问题苦恼过,那就是医疗器械注册单元的划分。企业所设计开发出的产品,其所包含的产品范围,是否可通过一个注册单元完成注册,从而
六年
医疗器械服务经验
联系思途,免费获得专属《落地解决方案》及报价
咨询相关问题或咨询报价,可以直接与我们联系
思途CRO——医疗器械注册临床第三方平台