医疗器械定期风险评价报告怎么写?还没审核通过的非看不可
发布日期:2023-10-10 阅读量:次
引言:你的医疗器械定期风险评价报告审核通过了吗?退回,退回,又是退回……你是否在一次次抓狂,一次次困扰,这个定期风险评价报告到底咋写啊?
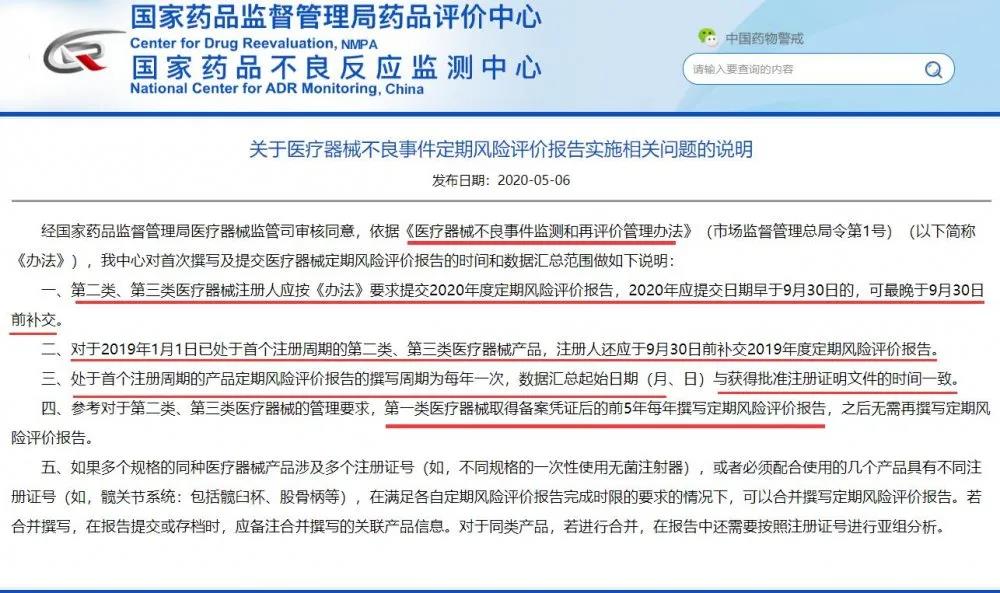
自2020年5月一则关于医疗器械不良事件定期风险评价报告实施相关问题的说明在圈里激起了涟漪,从自己是否需要写到需要怎么写,圈里也开始了各种解读以及流传各种模板,且国家药监局也于2020年7月发布医疗器械定期风险评价报告撰写规范的通告。然而即使如此,仍然好多同行被一次次审核退回给搞得束手无策,无从下手。为此小编将各位同行遇到的常见问题进行了整理,主要审核意见大致如下:
1.不良事件来源未补充投诉、文献和研究项目
不良事件来源有自发报告、研究、数据收集项目、文献、投诉等。这里企业常常仅对收集到的自发报告以及数据收集项目(查询医疗器械警戒快讯、医疗器械不良事件信息通报以及医疗器械召回信息)进行描述,往往忽略了投诉、文献和研究项目的内容。
2. 其他风险信息未定期、全面地收集,并进行综述——主要有同类产品、查新查全的问题
此类问题往往是因为企业忽略同类产品,以及检索数据库不齐全等。以下是器审中心发布的医疗器械不良事件检索方式及案例解析,有需要的可以了解并学习:https://mp.weixin.qq.com/s/4V7pqh9DDFCRlPIkuMKJew
3. 未按要求开展风险分析——主要有明确具体产品所有已知风险并结合具体不良事件开展定期风险评审
这里很多企业会出现套用上市前医疗器械风险管理报告格式和内容的误区,此处应根据上市后监测信息开展风险分析需从搜集到的不良事件报告进行定期风险管理与分析。
4. 情况说明或报告结论描述过于简单,请对报告进行摘要
此处应指出本期报告与既往报告的风险分析结果差异;以及以上风险差异的可接受程度;总结采取的风险控制措施并说明其必要性等等。
联系我们
如果您有任何关于医疗器械定期风险评价报告方面的问题或需求,欢迎联系我们,联系方式:18603823910(微信同号) 高先生。

站点声明
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
郑州思途医疗科技有限公司专注于医疗器械产品政策与法规规事务服务,提供产品注册备案申报代理、临床试验、体系建立辅导、分类界定、申请创新办理服务。
行业资讯
知识分享





 豫公网安备 41010202003160号
豫公网安备 41010202003160号